Rozwiązywanie zadań z chemii, zwłaszcza tych dotyczących stężenia procentowego, często bywa wyzwaniem dla uczniów i studentów. Jest to jednak fundamentalna umiejętność, która otwiera drzwi do zrozumienia wielu procesów chemicznych i ich zastosowań w życiu codziennym. W tym artykule, jako Igor Lis, przeprowadzę Cię krok po kroku przez meandry obliczeń stężenia procentowego, dostarczając praktycznych przykładów i wskazówek, które pomogą Ci opanować ten temat.
Klucz do rozwiązywania zadań ze stężenia procentowego zrozumienie wzorów i praktyka obliczeń
- Stężenie procentowe (Cp) to stosunek masy substancji rozpuszczonej (ms) do masy całego roztworu (mr), wyrażony w procentach.
- Podstawowy wzór to Cp = (ms / mr) * 100%, gdzie masa roztworu (mr) jest sumą masy substancji (ms) i masy rozpuszczalnika (mrozp).
- Gęstość (d) jest kluczowa do przeliczania objętości roztworu (V) na jego masę (mr = d * V).
- Artykuł omawia typowe zadania, takie jak obliczanie Cp, ms, mr, mrozp, a także zagadnienia związane z mieszaniem, zatężaniem i rozcieńczaniem roztworów.
- Kluczowe jest unikanie powszechnych błędów, np. mylenia masy roztworu z masą rozpuszczalnika oraz problemów z przekształcaniem wzorów i jednostkami.
Stężenie procentowe to jedno z najbardziej podstawowych pojęć w chemii, które pozwala nam określić, ile substancji rozpuszczonej znajduje się w danej ilości roztworu. Jego zrozumienie jest absolutnie kluczowe nie tylko dla dalszej nauki chemii, ale także dla praktycznego zastosowania tej wiedzy. Bez solidnych podstaw w tym zakresie, trudno będzie Ci przejść do bardziej złożonych zagadnień, takich jak stechiometria czy kinetyka reakcji.
Co więcej, stężenie procentowe otacza nas w życiu codziennym. Warto zdać sobie sprawę, jak często spotykamy się z tym pojęciem:
- Na etykietach produktów spożywczych, np. zawartość tłuszczu w mleku (3,2% tłuszczu).
- W składzie środków czystości, np. stężenie chloru w wybielaczu.
- W farmacji, np. stężenie substancji czynnej w lekach czy roztworach do iniekcji.
- W kosmetykach, np. zawartość alkoholu w perfumach.
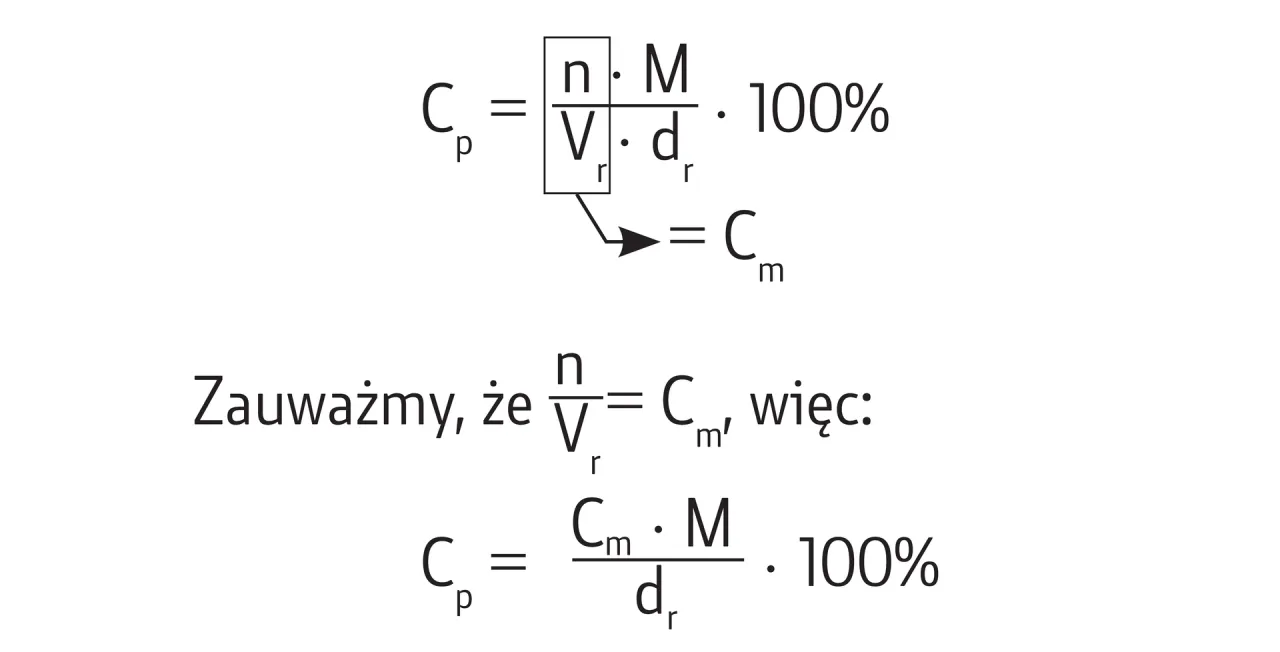
Podstawy stężenia procentowego: definicje i wzory
Zanim przejdziemy do rozwiązywania zadań, musimy upewnić się, że rozumiemy podstawowe pojęcia. To fundament, na którym zbudujemy całą naszą wiedzę. Pamiętaj, że precyzyjne definicje to klucz do sukcesu.
Stężenie procentowe (Cp) to nic innego jak stosunek masy substancji rozpuszczonej do masy całego roztworu, wyrażony w procentach. Mówiąc prościej, informuje nas, ile gramów substancji znajduje się w 100 gramach roztworu. Jego podstawowy wzór to: Cp = (ms / mr) * 100%.
Masa substancji (ms) to po prostu masa tej części roztworu, która uległa rozpuszczeniu. Może to być sól, cukier, kwas cokolwiek, co dodajemy do rozpuszczalnika.
Masa rozpuszczalnika (mrozp) to masa cieczy (lub innej substancji), w której rozpuszczamy naszą substancję. W zdecydowanej większości zadań szkolnych, a także w wielu zastosowaniach praktycznych, rozpuszczalnikiem jest woda.
Masa roztworu (mr) to suma masy substancji rozpuszczonej i masy rozpuszczalnika. To bardzo ważna zależność, o której nie wolno zapominać: mr = ms + mrozp. Często to właśnie tutaj pojawiają się pierwsze błędy, gdy ktoś myli masę roztworu z masą samego rozpuszczalnika.
Praktyczne przykłady zadań z chemii krok po kroku
Teoria to jedno, ale prawdziwe zrozumienie przychodzi z praktyką. W tej sekcji przedstawię Ci szereg praktycznych przykładów zadań z chemii, pokazując krok po kroku, jak stosować wzory na stężenie procentowe. Zobaczysz, że z odpowiednim podejściem, każde zadanie da się rozwiązać.
Obliczanie stężenia procentowego (Cp)
Zacznijmy od najprostszego scenariusza obliczania stężenia procentowego, gdy znamy masę substancji i rozpuszczalnika.
- Analiza zadania: W 200 g wody rozpuszczono 50 g chlorku sodu (NaCl). Oblicz stężenie procentowe otrzymanego roztworu.
-
Zapisanie danych:
- Masa substancji (ms) = 50 g NaCl
- Masa rozpuszczalnika (mrozp) = 200 g wody
-
Obliczenie masy roztworu (mr):
- mr = ms + mrozp
- mr = 50 g + 200 g = 250 g
-
Zastosowanie wzoru na stężenie procentowe:
- Cp = (ms / mr) * 100%
- Cp = (50 g / 250 g) * 100%
- Cp = 0,2 * 100% = 20%
- Odpowiedź: Stężenie procentowe otrzymanego roztworu wynosi 20%.
Obliczanie masy substancji (ms)
Teraz spróbujmy obliczyć masę substancji, gdy znamy stężenie procentowe i masę roztworu.
- Analiza zadania: Ile gramów cukru należy rozpuścić w wodzie, aby otrzymać 300 g roztworu o stężeniu 15%?
-
Zapisanie danych:
- Stężenie procentowe (Cp) = 15%
- Masa roztworu (mr) = 300 g
-
Przekształcenie wzoru na ms:
- Cp = (ms / mr) * 100%
- ms = (Cp * mr) / 100%
-
Wykonanie obliczeń:
- ms = (15% * 300 g) / 100%
- ms = (15 * 300) / 100 g
- ms = 4500 / 100 g = 45 g
- Odpowiedź: Należy rozpuścić 45 g cukru.
Obliczanie masy roztworu (mr)
A co, jeśli chcemy wiedzieć, ile roztworu możemy przygotować z danej ilości substancji?
- Analiza zadania: Ile gramów 25% roztworu kwasu siarkowego (H₂SO₄) można otrzymać, mając do dyspozycji 75 g czystego kwasu?
-
Zapisanie danych:
- Stężenie procentowe (Cp) = 25%
- Masa substancji (ms) = 75 g H₂SO₄
-
Przekształcenie wzoru na mr:
- Cp = (ms / mr) * 100%
- mr = (ms * 100%) / Cp
-
Wykonanie obliczeń:
- mr = (75 g * 100%) / 25%
- mr = (75 * 100) / 25 g
- mr = 7500 / 25 g = 300 g
- Odpowiedź: Można otrzymać 300 g 25% roztworu kwasu siarkowego.
Obliczanie masy rozpuszczalnika (mrozp)
Często zadania wymagają obliczenia masy rozpuszczalnika. Zazwyczaj jest to kolejny krok po obliczeniu ms i mr.
- Analiza zadania: Ile gramów wody należy dodać do 60 g substancji, aby otrzymać 12% roztwór?
-
Zapisanie danych:
- Masa substancji (ms) = 60 g
- Stężenie procentowe (Cp) = 12%
-
Obliczenie masy roztworu (mr) krok pośredni:
- mr = (ms * 100%) / Cp
- mr = (60 g * 100%) / 12%
- mr = 6000 / 12 g = 500 g
-
Obliczenie masy rozpuszczalnika (mrozp):
- mrozp = mr - ms
- mrozp = 500 g - 60 g = 440 g
- Odpowiedź: Należy dodać 440 g wody.
Rola gęstości w obliczeniach stężenia procentowego
W bardziej zaawansowanych zadaniach ze stężenia procentowego bardzo często pojawia się pojęcie gęstości. Jest to kluczowy element, który pozwala nam przeliczać objętość roztworu na jego masę, co jest niezbędne, gdy dane są podane w jednostkach objętości, a nie masy.
Gęstość (d) to stosunek masy substancji do jej objętości. Wyrażamy ją zazwyczaj w g/cm³ (lub g/ml) lub kg/dm³. Wzór na gęstość to d = m / V. Przekształcając go, otrzymujemy wzór na masę roztworu: mr = d * V. Pamiętaj, że gęstość wody jest wyjątkowa wynosi 1 g/cm³ (lub 1 g/ml). Oznacza to, że 1 ml wody waży dokładnie 1 g, co bardzo upraszcza wiele szkolnych zadań.
Zadanie z wykorzystaniem gęstości
Zobaczmy, jak gęstość zmienia podejście do zadania.
- Analiza zadania: Oblicz stężenie procentowe roztworu, który otrzymano przez rozpuszczenie 30 g substancji w 200 cm³ wody. Gęstość roztworu wynosi 1,1 g/cm³.
-
Zapisanie danych:
- Masa substancji (ms) = 30 g
- Objętość wody (Vwody) = 200 cm³
- Gęstość roztworu (d) = 1,1 g/cm³
-
Obliczenie masy wody (mrozp):
- Ponieważ gęstość wody wynosi 1 g/cm³, masa 200 cm³ wody to 200 g.
- mrozp = 200 g
-
Obliczenie masy roztworu (mr):
- W tym zadaniu mamy podaną gęstość całego roztworu. Musimy najpierw obliczyć objętość roztworu.
- Objętość roztworu (Vr) = objętość substancji + objętość wody. Jednak objętość substancji nie jest podana. Zamiast tego, możemy obliczyć masę roztworu z sumy ms i mrozp, a następnie sprawdzić, czy dane o gęstości są spójne lub użyć ich do obliczenia objętości roztworu.
- W tym konkretnym zadaniu, jeśli gęstość roztworu jest podana, to zazwyczaj zakłada się, że odnosi się ona do objętości końcowej roztworu. Jednak skoro mamy masę substancji i objętość wody, to masa roztworu będzie sumą ms i mrozp.
- mr = ms + mrozp = 30 g + 200 g = 230 g
- (Uwaga: Jeśli zadanie podałoby objętość całego roztworu i jego gęstość, wtedy mr = d * Vroztworu. Tutaj mamy objętość rozpuszczalnika, więc masa roztworu to suma mas).
-
Zastosowanie wzoru na stężenie procentowe:
- Cp = (ms / mr) * 100%
- Cp = (30 g / 230 g) * 100%
- Cp ≈ 0,1304 * 100% ≈ 13,04%
- Odpowiedź: Stężenie procentowe roztworu wynosi około 13,04%.
Mieszanie, zatężanie i rozcieńczanie roztworów
W praktyce laboratoryjnej i przemysłowej rzadko kiedy przygotowujemy roztwory "od zera". Znacznie częściej musimy modyfikować już istniejące mieszać je z innymi, zatężać (zwiększać stężenie) lub rozcieńczać (zmniejszać stężenie). To są typowe zadania, które wymagają nieco bardziej złożonego podejścia, ale nadal opierają się na tych samych podstawowych wzorach.
Mieszanie dwóch roztworów
Kiedy mieszamy roztwory, musimy pamiętać o zasadzie zachowania masy sumujemy masy substancji i sumujemy masy roztworów.
- Analiza zadania: Zmieszano 150 g 10% roztworu NaOH z 250 g 20% roztworu NaOH. Oblicz stężenie procentowe otrzymanego roztworu.
-
Zapisanie danych dla każdego roztworu:
- Roztwór 1: mr1 = 150 g, Cp1 = 10%
- Roztwór 2: mr2 = 250 g, Cp2 = 20%
-
Obliczenie masy substancji w każdym roztworze:
- ms1 = (Cp1 * mr1) / 100% = (10% * 150 g) / 100% = 15 g
- ms2 = (Cp2 * mr2) / 100% = (20% * 250 g) / 100% = 50 g
-
Obliczenie całkowitej masy substancji (ms_total) i całkowitej masy roztworu (mr_total):
- ms_total = ms1 + ms2 = 15 g + 50 g = 65 g
- mr_total = mr1 + mr2 = 150 g + 250 g = 400 g
-
Obliczenie końcowego stężenia procentowego:
- Cp_final = (ms_total / mr_total) * 100%
- Cp_final = (65 g / 400 g) * 100%
- Cp_final = 0,1625 * 100% = 16,25%
- Odpowiedź: Stężenie procentowe otrzymanego roztworu wynosi 16,25%.
Zatężanie roztworu przez dodanie substancji
Zatężanie to proces zwiększania stężenia. Najczęściej odbywa się przez dodanie większej ilości substancji rozpuszczonej.
- Analiza zadania: Do 200 g 10% roztworu NaCl dodano 20 g czystego NaCl. Oblicz stężenie procentowe otrzymanego roztworu.
-
Zapisanie danych początkowych:
- Masa początkowego roztworu (mr_pocz) = 200 g
- Stężenie początkowe (Cp_pocz) = 10%
- Dodana masa substancji (ms_dod) = 20 g
-
Obliczenie masy substancji w początkowym roztworze:
- ms_pocz = (Cp_pocz * mr_pocz) / 100% = (10% * 200 g) / 100% = 20 g
-
Obliczenie całkowitej masy substancji (ms_total) i całkowitej masy roztworu (mr_total) po dodaniu:
- ms_total = ms_pocz + ms_dod = 20 g + 20 g = 40 g
- mr_total = mr_pocz + ms_dod = 200 g + 20 g = 220 g (Pamiętaj, że dodana substancja zwiększa masę całego roztworu!)
-
Obliczenie końcowego stężenia procentowego:
- Cp_final = (ms_total / mr_total) * 100%
- Cp_final = (40 g / 220 g) * 100%
- Cp_final ≈ 0,1818 * 100% ≈ 18,18%
- Odpowiedź: Stężenie procentowe otrzymanego roztworu wynosi około 18,18%.
Rozcieńczanie roztworu przez dodanie rozpuszczalnika
Rozcieńczanie to proces zmniejszania stężenia, najczęściej przez dodanie rozpuszczalnika (wody).
- Analiza zadania: Do 300 g 20% roztworu cukru dodano 100 g wody. Oblicz stężenie procentowe otrzymanego roztworu.
-
Zapisanie danych początkowych:
- Masa początkowego roztworu (mr_pocz) = 300 g
- Stężenie początkowe (Cp_pocz) = 20%
- Dodana masa wody (mrozp_dod) = 100 g
-
Obliczenie masy substancji w początkowym roztworze:
- ms = (Cp_pocz * mr_pocz) / 100% = (20% * 300 g) / 100% = 60 g (Pamiętaj, że masa substancji się nie zmienia!)
-
Obliczenie całkowitej masy roztworu (mr_total) po dodaniu wody:
- mr_total = mr_pocz + mrozp_dod = 300 g + 100 g = 400 g
-
Obliczenie końcowego stężenia procentowego:
- Cp_final = (ms / mr_total) * 100%
- Cp_final = (60 g / 400 g) * 100%
- Cp_final = 0,15 * 100% = 15%
- Odpowiedź: Stężenie procentowe otrzymanego roztworu wynosi 15%.
Metoda krzyżowa (reguła mieszania)
Metoda krzyżowa, znana również jako reguła mieszania, to bardzo przydatny, graficzny sposób na szybkie obliczenia przy mieszaniu roztworów. Jest szczególnie efektywna, gdy chcemy uzyskać roztwór o określonym stężeniu z dwóch roztworów o różnych stężeniach. Polega na ułożeniu stężeń roztworów wyjściowych i stężenia roztworu końcowego w formie "krzyża", a następnie odejmowaniu wartości po przekątnych, aby uzyskać stosunek mas, w jakich należy zmieszać roztwory. To narzędzie, które pozwala zaoszczędzić sporo czasu, zwłaszcza w zadaniach testowych.Najczęstsze błędy i jak ich unikać
Wiem z doświadczenia, że nawet najlepiej opanowana teoria może legnąć w gruzach, jeśli nie zwrócimy uwagi na typowe pułapki. Świadomość najczęstszych błędów jest kluczowa dla sukcesu w rozwiązywaniu zadań ze stężenia procentowego. Pozwól, że wskażę Ci, na co szczególnie uważać.
Mylenie masy roztworu z masą rozpuszczalnika
To jest absolutnie najczęstszy błąd, jaki widuję u moich podopiecznych. Wiele osób, widząc w zadaniu "masa wody", automatycznie wstawia tę wartość do mianownika wzoru na stężenie procentowe. Pamiętaj jednak, że wzór Cp = (ms / mr) * 100% wymaga w mianowniku masy całego roztworu (mr), która jest sumą masy substancji (ms) i masy rozpuszczalnika (mrozp)! Jeśli w zadaniu podana jest tylko masa rozpuszczalnika, musisz najpierw obliczyć mr, dodając do niej masę substancji. Nigdy nie zapominaj o tym kluczowym rozróżnieniu!
Problemy z przekształcaniem wzorów
Często widzę, że uczniowie mają trudności z algebraicznym przekształcaniem podstawowego wzoru na stężenie procentowe, aby wyliczyć ms lub mr. To umiejętność matematyczna, która jest niezbędna w chemii. Jeśli masz problem z przekształceniem równania Cp = (ms / mr) * 100%, aby wyznaczyć ms lub mr, poćwicz to. Pamiętaj, że mnożenie i dzielenie przez 100% to stały element, który musi być uwzględniony. Zawsze staraj się izolować szukaną zmienną po jednej stronie równania, wykonując te same operacje po obu stronach.
Niespójność jednostek
Kolejnym źródłem błędów jest niewłaściwe zarządzanie jednostkami. Jeśli masa substancji jest podana w gramach, a objętość rozpuszczalnika w litrach, musisz przeliczyć je na spójne jednostki (np. wszystko na gramy i mililitry, lub gramy i centymetry sześcienne). Mieszanie gramów z kilogramami, czy cm³ z dm³ bez odpowiedniego przeliczenia (np. wiedząc, że 1 kg = 1000 g, a 1 dm³ = 1000 cm³) prowadzi do błędnych wyników. Zawsze sprawdzaj jednostki na początku i na końcu obliczeń, aby upewnić się, że są spójne i logiczne.
Skuteczne strategie rozwiązywania zadań
Aby uniknąć frustracji i systematycznie podchodzić do każdego zadania, warto wypracować sobie uniwersalne strategie. Przedstawię Ci teraz kroki, które pomogą Ci w systematycznym i skutecznym rozwiązywaniu każdego zadania ze stężenia procentowego.
Analiza zadania: co jest dane, co jest szukane?
Pierwszy i absolutnie kluczowy krok w rozwiązywaniu każdego zadania to jego dokładna analiza. Nie rzucaj się od razu na obliczenia! Najpierw przeczytaj zadanie kilka razy, zrozum kontekst i zidentyfikuj: co jest dane (np. masa substancji, masa roztworu, stężenie procentowe, gęstość, objętość) oraz co należy obliczyć (np. Cp, ms, mr, mrozp). Wypisz te dane i szukane wartości w formie listy, używając odpowiednich symboli (ms, mr, Cp itp.). To pomoże Ci uporządkować informacje i wybrać odpowiedni wzór.Przeczytaj również: Bezpieczna elektroliza wody w domu? Zrób to z sodą oczyszczoną!
Uniwersalne kroki do sukcesu
Oto uniwersalna, numerowana lista kroków, które powinieneś podjąć przy rozwiązywaniu każdego zadania ze stężenia procentowego:
- Dokładnie przeczytaj zadanie: Upewnij się, że rozumiesz, o co chodzi. Zwróć uwagę na słowa kluczowe (np. "rozpuszczono w wodzie", "otrzymano roztwór").
- Wypisz dane i szukane: Zanotuj wszystkie podane wartości i to, co masz obliczyć, używając symboli (ms, mr, Cp, d, V).
- Sprawdź jednostki: Upewnij się, że wszystkie jednostki są spójne. Jeśli nie, przelicz je na wspólne (np. wszystkie masy na gramy, wszystkie objętości na cm³).
- Wybierz odpowiedni wzór: Na podstawie danych i szukanych, zdecyduj, który wzór na stężenie procentowe (lub jego przekształcenie) będzie najbardziej odpowiedni.
- Przekształć wzór (jeśli to konieczne): Jeśli szukasz ms lub mr, przekształć główny wzór, aby wyizolować szukaną zmienną.
- Wykonaj obliczenia: Podstaw wartości do wzoru i wykonaj obliczenia. Korzystaj z kalkulatora, ale zawsze kontroluj logiczność wyniku.
- Zapisz wynik z jednostką: Pamiętaj o podaniu prawidłowej jednostki (np. %, g, cm³).
- Sprawdź wynik: Zastanów się, czy wynik jest sensowny. Czy stężenie procentowe nie jest zbyt wysokie (powyżej 100%) lub zbyt niskie (ujemne)? Czy masa substancji nie jest większa niż masa roztworu?

