Bezpieczna elektroliza wody w domu prosty eksperyment z sodą oczyszczoną
- Elektroliza to rozkład wody na wodór i tlen za pomocą prądu elektrycznego, możliwy do przeprowadzenia w domu.
- Kluczowe dla bezpieczeństwa jest użycie sody oczyszczonej jako elektrolitu; sól kuchenna jest absolutnie zakazana ze względu na wydzielanie toksycznego chloru.
- Do eksperymentu potrzebujesz baterii 9V, elektrod grafitowych lub ze stali nierdzewnej oraz szklanego naczynia.
- Należy zachować szczególną ostrożność: pracować w wentylowanym pomieszczeniu, używać okularów ochronnych i wyłącznie niskonapięciowych źródeł prądu.
- Podczas eksperymentu zaobserwujesz pęcherzyki wodoru (dwukrotnie więcej) i tlenu na odpowiednich elektrodach.

Przygotowanie do eksperymentu: Co warto wiedzieć o elektrolizie wody?
Czym jest elektroliza? Proste wyjaśnienie dla każdego
Elektroliza wody to proces chemiczny, w którym cząsteczki wody (H₂O) są rozkładane na swoje podstawowe pierwiastki: wodór (H₂) i tlen (O₂) pod wpływem prądu elektrycznego. To nic innego jak wymuszona reakcja chemiczna, która zachodzi dzięki dostarczeniu energii elektrycznej. W efekcie, na jednej elektrodzie zbiera się wodór, a na drugiej tlen. Jest to podstawowa metoda pozyskiwania tych gazów w przemyśle, a w warunkach domowych pozwala nam na własne oczy zobaczyć, z czego składa się woda.
Dlaczego czysta woda nie przewodzi prądu, czyli po co nam elektrolit?
Zapewne wiesz, że woda przewodzi prąd, ale czy wiesz, że czysta woda, czyli woda demineralizowana, przewodzi go bardzo słabo? To dlatego, że nie zawiera ona wystarczającej liczby wolnych jonów, które mogłyby przenosić ładunek elektryczny. Aby elektroliza mogła efektywnie zachodzić, potrzebujemy zwiększyć przewodnictwo roztworu. W tym celu dodajemy elektrolit substancję, która po rozpuszczeniu w wodzie dysocjuje na jony, umożliwiając swobodny przepływ prądu. Bez elektrolitu reakcja byłaby niezwykle powolna lub w ogóle by nie zaszła.
Kluczowe zasady bezpieczeństwa: Tego absolutnie nie wolno ignorować!
Z mojego doświadczenia wiem, że bezpieczeństwo to podstawa każdego eksperymentu chemicznego, zwłaszcza w domu. Pamiętaj, że elektroliza wody, choć prosta, wiąże się z pewnymi ryzykami, które należy bezwzględnie minimalizować. Oto najważniejsze zasady:
- Pracuj w wentylowanym pomieszczeniu: Wodór jest gazem skrajnie łatwopalnym i w mieszaninie z powietrzem tworzy mieszaninę wybuchową. Zawsze upewnij się, że pomieszczenie jest dobrze wietrzone, aby uniknąć gromadzenia się wodoru.
- ABSOLUTNY ZAKAZ używania soli kuchennej (NaCl): To jest najważniejsze ostrzeżenie! Użycie soli kuchennej jako elektrolitu spowoduje wydzielanie się toksycznego i żrącego gazu chloru (Cl₂), a nie tlenu. Chlor jest bardzo niebezpieczny dla zdrowia i środowiska, dlatego nigdy nie używaj soli kuchennej w domowej elektrolizie.
- Noś okulary ochronne: Zawsze zalecam ochronę oczu, aby zabezpieczyć się przed przypadkowym rozpryskiem roztworu.
- Używaj wyłącznie niskonapięciowych źródeł prądu stałego: Do eksperymentu używaj tylko baterii (np. 9V). Nigdy nie używaj zasilaczy sieciowych, ponieważ grozi to porażeniem prądem.
- Przeprowadzaj eksperyment na małą skalę: Małe naczynie i niewielkie ilości odczynników to klucz do bezpiecznego i kontrolowanego eksperymentu.

Niezbędne wyposażenie: Co przygotować do domowej elektrolizy?
Wybór źródła prądu: Dlaczego bateria 9V to najlepszy i najbezpieczniejszy start?
Dla domowej elektrolizy wody kluczowe jest bezpieczne źródło prądu stałego. Zdecydowanie najlepszym i najbezpieczniejszym wyborem dla początkujących jest bateria 9V (np. popularna bateria 6F22). Jej napięcie jest wystarczające do zainicjowania reakcji, a jednocześnie na tyle niskie, że minimalizuje ryzyko porażenia prądem. Możesz również użyć kilku baterii AA 1,5V połączonych szeregowo, aby uzyskać podobne napięcie. Z mojego doświadczenia wynika, że zasilacze sieciowe są odradzane, ponieważ wiążą się z ryzykiem porażenia prądem zmiennym, a ich niewłaściwe użycie może być bardzo niebezpieczne.
Jakie elektrody sprawdzą się najlepiej? Grafit kontra stal nierdzewna
Wybór odpowiednich elektrod jest istotny dla bezpieczeństwa i efektywności eksperymentu. Oto, co polecam:
- Pręty grafitowe: Są idealne, ponieważ grafit jest dobrym przewodnikiem i jest chemicznie obojętny, co oznacza, że nie będzie reagował z roztworem. Możesz je pozyskać ze starych baterii R20 (należy je ostrożnie rozebrać i wyjąć grafitowy pręt z wnętrza) lub kupić w sklepach modelarskich.
- Elementy ze stali nierdzewnej: Dwa takie same widelce, łyżki, śruby lub inne przedmioty wykonane ze stali nierdzewnej również dobrze się sprawdzą. Stal nierdzewna jest stosunkowo obojętna i nie powinna znacząco korodować podczas krótkiego eksperymentu.
Unikaj materiałów takich jak miedź, aluminium czy zwykła stal. Te metale mogą wchodzić w reakcje uboczne z elektrolitem, co prowadzi do zanieczyszczenia roztworu, korozji elektrod i niepożądanych produktów reakcji.
Najważniejsza decyzja: Elektrolit, który gwarantuje bezpieczeństwo (Soda oczyszczona)
Wybór elektrolitu to kluczowa decyzja dla bezpieczeństwa całego eksperymentu. Zdecydowanie zalecam użycie wodorowęglanu sodu (sody oczyszczonej), który jest łatwo dostępny w każdej kuchni. Inną bezpieczną opcją jest siarczan sodu (Na₂SO₄). Oba te związki są doskonałymi elektrolitami i co najważniejsze, nie powodują wydzielania szkodliwych gazów podczas elektrolizy wody. Dzięki nim na anodzie wydzieli się czysty tlen, a na katodzie wodór, zgodnie z naszym celem.
Ostrzeżenie: Dlaczego NIGDY nie używać soli kuchennej (NaCl)! Użycie soli kuchennej jako elektrolitu prowadzi do wydzielania się toksycznego gazu chloru (Cl₂), który jest niebezpieczny dla zdrowia. Eksperyment z solą może również spowodować, że woda przybierze zielonkawo-żółty kolor. Zawsze wybieraj sodę oczyszczoną!
Przygotowanie naczynia i przewodów: Ostatni krok przed startem
Do przeprowadzenia eksperymentu potrzebujesz przezroczystego, szklanego naczynia, które pozwoli Ci obserwować zachodzące reakcje. Idealnie sprawdzi się zwykły słoik lub szklanka. Ponadto, przygotuj dwa przewody z krokodylkami na końcach. Posłużą one do łatwego i bezpiecznego podłączenia baterii do elektrod. Upewnij się, że izolacja przewodów jest nienaruszona, aby uniknąć przypadkowych zwarć.
Elektroliza wody krok po kroku: Jak bezpiecznie przeprowadzić eksperyment?
Teraz, gdy masz już wszystkie materiały i znasz zasady bezpieczeństwa, możemy przejść do właściwego eksperymentu. Postępuj zgodnie z poniższymi instrukcjami, aby bezpiecznie przeprowadzić elektrolizę wody.
-
Krok 1: Przygotowanie roztworu sody oczyszczonej jakie proporcje zastosować?
Napełnij szklane naczynie wodą (najlepiej destylowaną, ale zwykła kranówka też się nada). Następnie dodaj do wody niewielką ilość sody oczyszczonej wystarczy jedna łyżeczka na szklankę wody. Dokładnie wymieszaj, aż soda całkowicie się rozpuści. Nie potrzebujesz dużego stężenia, aby roztwór dobrze przewodził prąd.
-
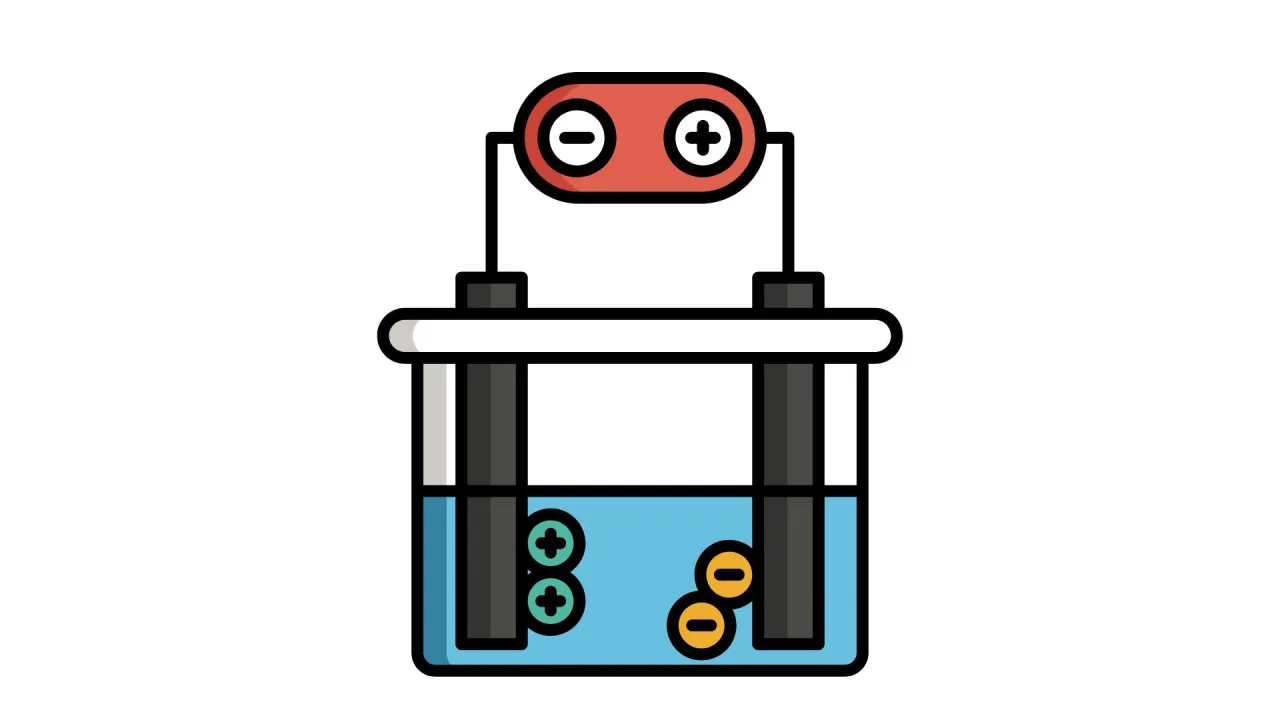
Krok 2: Montaż zestawu jak poprawnie zanurzyć elektrody i podłączyć zasilanie?
Zanurz obie elektrody w roztworze sody oczyszczonej. Upewnij się, że elektrody nie dotykają się nawzajem, ponieważ spowodowałoby to zwarcie. Następnie podłącz przewody z krokodylkami: jeden koniec do elektrody, drugi do baterii 9V. Z mojego doświadczenia wiem, że ważne jest, aby pamiętać, że elektroda podłączona do bieguna ujemnego (-) baterii to katoda, a elektroda podłączona do bieguna dodatniego (+) to anoda.
-
Krok 3: Czas na obserwację! Jak rozpoznać wodór i tlen na elektrodach?
Po podłączeniu zasilania natychmiast powinieneś zaobserwować pojawianie się pęcherzyków gazu na obu elektrodach. To jest właśnie elektroliza w akcji! Oto, co dokładnie zobaczysz:
- Na katodzie (biegun ujemny "-") będą wydzielać się pęcherzyki wodoru (H₂).
- Na anodzie (biegun dodatni "+") będą wydzielać się pęcherzyki tlenu (O₂).
- Zwróć uwagę, że na katodzie (tam, gdzie wydziela się wodór) będzie powstawać objętościowo dwa razy więcej gazu niż na anodzie. To kluczowa obserwacja, o której opowiem więcej w kolejnej sekcji.
-
Krok 4: Bezpieczne zakończenie eksperymentu i posprzątanie stanowiska
Gdy już nacieszysz się obserwacjami i zrozumiesz proces, bezpiecznie odłącz zasilanie, odpinając przewody od baterii. Roztwór sody oczyszczonej jest bezpieczny i możesz go wylać do zlewu. Elektrody i naczynie umyj i odłóż. Pamiętaj, aby zawsze po eksperymencie uporządkować stanowisko pracy.
Analiza wyników: Co obserwujemy podczas elektrolizy?
Równanie reakcji chemicznej: Rozszyfrujmy ten tajemniczy zapis
Podczas elektrolizy wody z obojętnym elektrolitem, takim jak soda oczyszczona, zachodzi następująca reakcja chemiczna. Zapisujemy ją w ten sposób:2H₂O → 2H₂ + O₂
Oznacza to, że dwie cząsteczki wody (H₂O) rozkładają się na dwie cząsteczki wodoru (H₂) i jedną cząsteczkę tlenu (O₂). Wodór wydziela się na katodzie (ujemnej elektrodzie), a tlen na anodzie (dodatniej elektrodzie).
Dlaczego na jednej z elektrod powstaje dwa razy więcej gazu?
To jedna z najbardziej intrygujących obserwacji w eksperymencie elektrolizy! Odpowiedź tkwi w stechiometrii reakcji, którą właśnie omówiliśmy. Zgodnie z równaniem 2H₂O → 2H₂ + O₂, z każdych dwóch cząsteczek wody powstają dwie cząsteczki wodoru i jedna cząsteczka tlenu. Oznacza to, że objętościowo wodoru jest zawsze dwa razy więcej niż tlenu. To bezpośrednie potwierdzenie składu chemicznego wody i jej wzoru H₂O.
Wodór jako paliwo przyszłości: Czy właśnie go wyprodukowałeś?
Tak, właśnie wyprodukowałeś wodór! Ten gaz jest często nazywany paliwem przyszłości ze względu na swoją wysoką wartość energetyczną i fakt, że jego spalanie produkuje jedynie wodę, co czyni go paliwem ekologicznym. Jednakże, ilość wodoru wyprodukowana w domowym eksperymencie jest znikoma i, co ważne, niebezpieczna do gromadzenia. Wodór jest wysoce łatwopalny i tworzy mieszaniny wybuchowe z powietrzem, dlatego nigdy nie próbuj zbierać go w zamkniętych pojemnikach w warunkach domowych. Nasz eksperyment ma cel edukacyjny, a nie produkcyjny.
Unikaj błędów: Jak zapewnić sukces i bezpieczeństwo eksperymentu?
Śmiertelne niebezpieczeństwo: Dlaczego NIGDY nie wolno używać soli kuchennej?
Z mojego punktu widzenia, to jest absolutnie najważniejsza informacja, którą musisz zapamiętać: NIGDY, przenigdy nie używaj chlorku sodu (soli kuchennej) jako elektrolitu w domowej elektrolizie wody! Powtarzam to z pełną stanowczością, ponieważ konsekwencje mogą być bardzo poważne. Na anodzie, zamiast bezpiecznego tlenu, wydzieli się toksyczny, żrący gaz chlor (Cl₂). Chlor jest gazem drażniącym drogi oddechowe, oczy i skórę, a w większych stężeniach może być śmiertelny. Dodatkowo, roztwór może przybrać niepokojący zielonkawo-żółty kolor. Zawsze, ale to zawsze, wybieraj sodę oczyszczoną lub siarczan sodu.
Moje elektrody rdzewieją lub się rozpuszczają: Co zrobiłem źle?
Jeśli zauważysz, że Twoje elektrody rdzewieją, zmieniają kolor lub wręcz się rozpuszczają podczas eksperymentu, oznacza to, że użyłeś niewłaściwych materiałów. Miedź, aluminium czy zwykła stal nie są odpowiednie do elektrolizy wody, ponieważ są aktywne chemicznie i wchodzą w reakcje uboczne z elektrolitem i produktami elektrolizy. W efekcie elektrody ulegają korozji, a roztwór zanieczyszcza się jonami metali. Aby tego uniknąć, zawsze używaj tylko grafitu lub stali nierdzewnej, które są znacznie bardziej obojętne chemicznie i stabilne w warunkach elektrolizy.
Przeczytaj również: Sprawdzian bez kalkulatora? Oblicz masę molową jak ekspert!
Brak bąbelków gazu? Sprawdź te 3 najczęstsze przyczyny
Jeśli podłączyłeś wszystko i nic się nie dzieje, nie martw się, to częsty problem początkujących. Zazwyczaj przyczyną jest jedna z trzech rzeczy:
- Słaba bateria: Bateria 9V może być zużyta lub mieć zbyt niskie napięcie, aby zainicjować reakcję. Spróbuj użyć nowej baterii.
- Niewystarczająca ilość elektrolitu: Jeśli dodałeś za mało sody oczyszczonej, woda nadal może słabo przewodzić prąd. Dodaj trochę więcej sody i dobrze wymieszaj.
- Złe połączenia elektryczne: Sprawdź, czy krokodylki są dobrze przymocowane do elektrod i do biegunów baterii. Czasem luźne połączenie może przerwać obwód.

