Witajcie w fascynującym świecie chemii zapachów! Ten artykuł to praktyczny przewodnik, który krok po kroku przeprowadzi Was przez proces laboratoryjnej syntezy estrów o owocowych aromatach. Zrozumienie podstaw chemii organicznej i możliwość samodzielnego tworzenia tych przyjemnych substancji to niezwykle satysfakcjonujące doświadczenie, ale pamiętajcie, że bezpieczeństwo w laboratorium jest zawsze priorytetem.
Estry o owocowych zapachach praktyczny przewodnik syntezy laboratoryjnej
- Estryfikacja Fischera to kluczowa reakcja chemiczna, pozwalająca na syntezę owocowych zapachów z kwasów karboksylowych i alkoholi.
- Do przeprowadzenia reakcji niezbędny jest katalizator, którym najczęściej jest stężony kwas siarkowy(VI).
- Konieczne jest użycie podstawowego sprzętu laboratoryjnego, takiego jak kolba, chłodnica zwrotna i rozdzielacz.
- Przykłady popularnych estrów to octan izoamylu (banan), maślan etylu (ananas) i maślan metylu (jabłko).
- Bezpieczeństwo jest priorytetem: praca pod wyciągiem, okulary ochronne i rękawice są obowiązkowe.
Estry i ich owocowe zapachy
Estry to organiczne związki chemiczne, które odgrywają kluczową rolę w świecie zapachów, szczególnie tych kojarzonych z owocami i kwiatami. To właśnie dzięki nim jabłka pachną jabłkami, a banany bananami! W chemii organicznej estry powstają w wyniku reakcji kwasów karboksylowych z alkoholami. Ich obecność w naturze jest powszechna i odpowiada za wiele przyjemnych aromatów, które codziennie spotykamy. Dla początkujących chemików i hobbystów eksperymenty z estrami są niezwykle interesujące i edukacyjne, ponieważ pozwalają na praktyczne zastosowanie wiedzy teoretycznej i obserwację fascynujących przemian chemicznych, które skutkują powstaniem zupełnie nowych, często bardzo intensywnych zapachów.
Jak działa estryfikacja Fischera
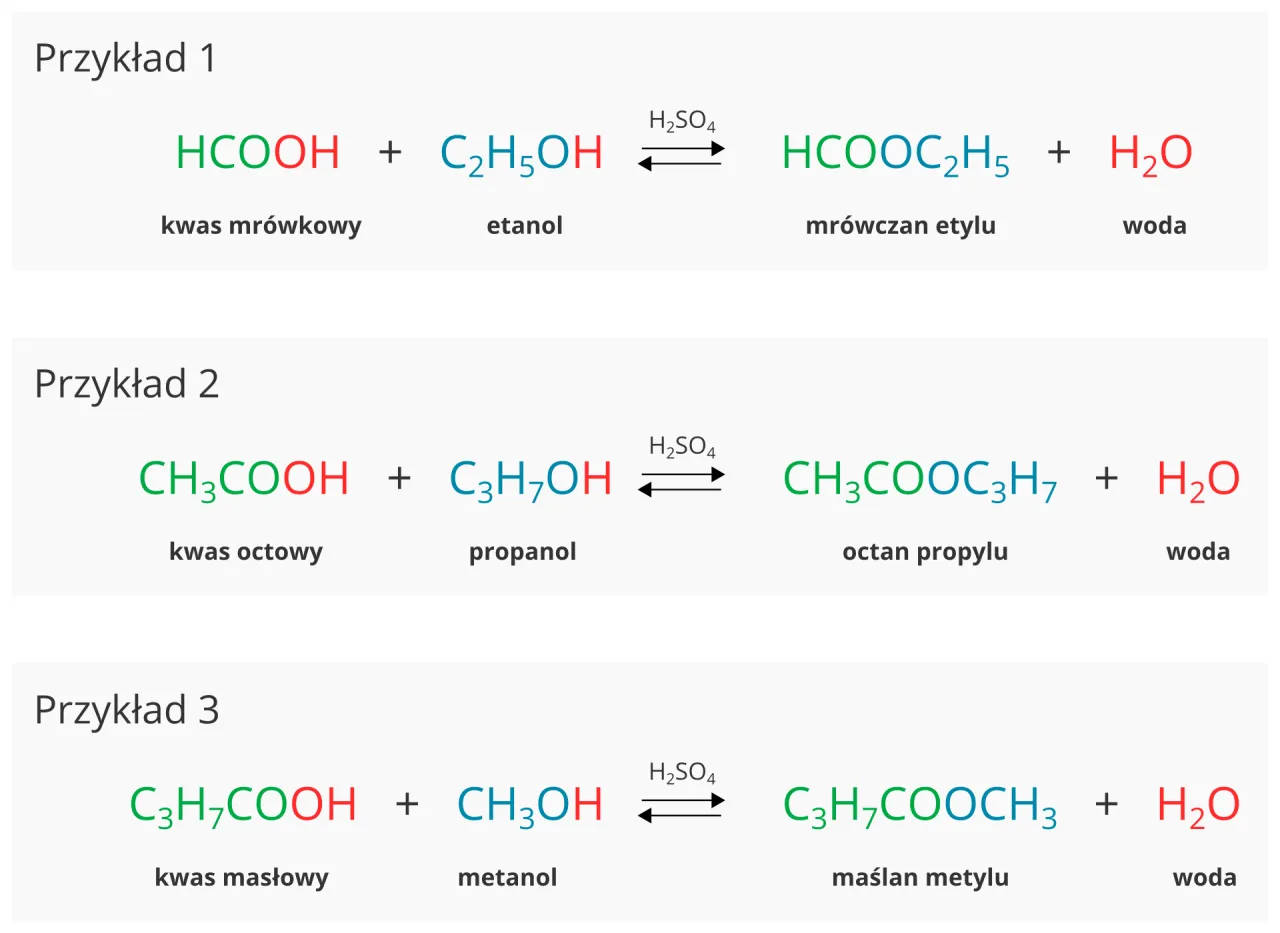
Kluczową metodą laboratoryjnego otrzymywania estrów o owocowych zapachach jest estryfikacja Fischera. Jest to reakcja odwracalna, w której kwas karboksylowy reaguje z alkoholem, tworząc ester i wodę. Ogólne równanie tej reakcji wygląda następująco: R-COOH + R'-OH ⇌ R-COO-R' + H₂O. Co istotne, reakcja ta wymaga obecności silnego kwasu jako katalizatora, a najczęściej stosowanym jest stężony kwas siarkowy(VI). Katalizator ten nie zużywa się w reakcji, lecz przyspiesza jej przebieg, obniżając energię aktywacji. Ponieważ estryfikacja Fischera jest reakcją równowagową, możemy wpływać na jej wydajność, przesuwając równowagę w stronę produktów. Jako doświadczony praktyk, zawsze staram się maksymalizować wydajność, stosując kilka sprawdzonych metod:
- Użycie nadmiaru jednego z substratów: Zazwyczaj stosuje się nadmiar tańszego i łatwiej dostępnego alkoholu, co zgodnie z zasadą Le Chateliera przesuwa równowagę w stronę tworzenia estru.
- Usuwanie wody ze środowiska reakcji: Ponieważ woda jest produktem ubocznym estryfikacji, jej usunięcie (np. poprzez destylację azeotropową) również skutecznie przesuwa równowagę w kierunku estru, zwiększając jego ilość.
- Dłuższy czas reakcji i odpowiednia temperatura: Choć katalizator przyspiesza reakcję, zapewnienie odpowiedniego czasu i temperatury (zazwyczaj ogrzewanie pod chłodnicą zwrotną) jest kluczowe dla osiągnięcia maksymalnej konwersji substratów.
Co potrzebujesz do syntezy estrów
Aby bezpiecznie i skutecznie przeprowadzić syntezę estrów w warunkach laboratoryjnych, potrzebujesz kilku podstawowych elementów wyposażenia. Niezbędna będzie kolba okrągłodenna (najczęściej o pojemności 100-250 ml), w której będzie zachodzić reakcja. Do niej podłączana jest chłodnica zwrotna, która zapobiega ucieczce lotnych substratów i produktów podczas ogrzewania. Przy dodawaniu katalizatora lub jednego z substratów przyda się wkraplacz, umożliwiający precyzyjne dozowanie. Po reakcji do izolacji produktu wykorzystamy rozdzielacz. Oprócz tego, do odmierzania cieczy potrzebne będą zlewki i cylindry miarowe, a do ogrzewania odpowiednie źródło ciepła, takie jak łaźnia wodna lub płaszcz grzejny. Pamiętajcie, że precyzja i czystość sprzętu są kluczowe dla sukcesu eksperymentu. A oto przykłady kwasów karboksylowych i alkoholi, które pozwolą Wam stworzyć różnorodne owocowe zapachy:
- Kwas octowy (CH₃COOH) + Alkohol izoamylowy (C₅H₁₁OH) → Octan izoamylu (banan)
- Kwas masłowy (CH₃CH₂CH₂COOH) + Etanol (CH₃CH₂OH) → Maślan etylu (ananas)
- Kwas masłowy (CH₃CH₂CH₂COOH) + Metanol (CH₃OH) → Maślan metylu (jabłko)
- Kwas mrówkowy (HCOOH) + Etanol (CH₃CH₂OH) → Mrówczan etylu (rum)
- Kwas antranilowy (C₆H₄(NH₂)COOH) + Metanol (CH₃OH) → Antranilan metylu (winogrona)
Krok po kroku: Synteza octanu izoamylu
Przyjrzyjmy się teraz szczegółowo procedurze syntezy jednego z najbardziej rozpoznawalnych owocowych estrów octanu izoamylu, który odpowiada za charakterystyczny zapach bananów. Do tej reakcji potrzebujemy kwasu octowego (najlepiej lodowatego), alkoholu izoamylowego (znanego również jako 3-metylobutan-1-ol) oraz stężonego kwasu siarkowego(VI) jako katalizatora. Zazwyczaj stosuję proporcje molowe, gdzie alkohol jest w lekkim nadmiarze, np. na każde 10 ml alkoholu izoamylowego używam około 8-9 ml kwasu octowego i zaledwie kilka kropli (około 1 ml) stężonego H₂SO₄. Pamiętajcie, aby zawsze dodawać kwas siarkowy ostrożnie!
Zanim zaczniemy, musimy prawidłowo zmontować zestaw laboratoryjny. W kolbie okrągłodennej umieszczamy substraty. Następnie do kolby montujemy chłodnicę zwrotną, którą podłączamy do obiegu wody chłodzącej. Całość umieszczamy na łaźni wodnej lub płaszczu grzejnym. Upewnijcie się, że wszystkie połączenia są szczelne, a sprzęt jest stabilny. To kluczowe dla bezpieczeństwa i efektywności reakcji.
- W czystej i suchej kolbie okrągłodennej umieść odmierzoną ilość alkoholu izoamylowego (np. 10 ml) i kwasu octowego (np. 9 ml).
- Ostrożnie, kroplami, dodaj około 1 ml stężonego kwasu siarkowego(VI) do mieszaniny, cały czas mieszając i chłodząc kolbę (np. w łaźni lodowej), aby zapobiec przegrzewaniu. Kwas siarkowy jest silnie egzotermiczny w kontakcie z wodą i alkoholem.
- Zmontuj zestaw do ogrzewania pod chłodnicą zwrotną i rozpocznij ogrzewanie. Mieszaninę reakcyjną utrzymuj w stanie łagodnego wrzenia przez około 30-60 minut. Ten czas jest wystarczający, aby reakcja osiągnęła stan równowagi.
- Po upływie wyznaczonego czasu, wyłącz ogrzewanie i pozwól mieszaninie ostygnąć do temperatury pokojowej. Możesz przyspieszyć ten proces, zanurzając kolbę w łaźni z zimną wodą.
Po ostygnięciu mieszaniny, przechodzimy do etapu izolacji i oczyszczania produktu. To moment, w którym zaczynamy wyczuwać bananowy zapach!
- Ostrożnie wlej ostudzoną mieszaninę reakcyjną do zlewki zawierającej około 50 ml zimnej wody lub rozcieńczonego roztworu węglanu sodu (Na₂CO₃). Węglan sodu zneutralizuje resztki nieprzereagowanego kwasu octowego i kwasu siarkowego.
- Przelej zawartość zlewki do rozdzielacza. Wstrząśnij delikatnie, uwalniając ciśnienie przez kranik. Pozwól warstwom się rozdzielić. Octan izoamylu, jako substancja mniej gęsta od wody, zazwyczaj utworzy górną warstwę.
- Odrzuć dolną warstwę wodną, a warstwę estrową przemyj ponownie niewielką ilością wody, a następnie roztworem wodorowęglanu sodu (aby upewnić się, że wszystkie kwasy zostały usunięte), a na koniec czystą wodą. Po każdym przemywaniu usuwaj warstwę wodną.
- Zebraną warstwę estrową możesz osuszyć nad bezwodnym siarczanem magnezu lub wapnia. Po osuszeniu, odsącz środek suszący i zbierz czysty octan izoamylu. Powinniście wyraźnie poczuć jego charakterystyczny, słodki zapach bananów!

Odkryj inne owocowe estry
Świat estrów jest naprawdę bogaty! Poza octanem izoamylu istnieje wiele innych związków, które można zsyntetyzować, aby uzyskać różnorodne owocowe aromaty. Poniżej przedstawiam kilka przykładów, które możecie spróbować otrzymać, stosując podobną procedurę, zmieniając jedynie substraty:
| Nazwa estru i jego zapach | Kwas karboksylowy i alkohol |
|---|---|
| Maślan etylu (ananas) | Kwas masłowy + Etanol |
| Maślan metylu (jabłko) | Kwas masłowy + Metanol |
| Mrówczan etylu (rum) | Kwas mrówkowy + Etanol |
| Antranilan metylu (winogrona) | Kwas antranilowy + Metanol |
Bezpieczeństwo przede wszystkim w laboratorium
Jako Igor Lis, zawsze podkreślam, że bezpieczeństwo w laboratorium jest absolutnie najważniejsze. Praca z chemikaliami, zwłaszcza stężonymi kwasami i łatwopalnymi rozpuszczalnikami, wymaga ostrożności i ścisłego przestrzegania zasad. Nie lekceważcie żadnego z poniższych punktów to one zapewniają Wam ochronę:
- Praca pod wyciągiem (dygestorium): Wiele kwasów karboksylowych, alkoholi i estrów ma intensywny zapach, a niektóre opary mogą być drażniące lub toksyczne. Dygestorium zapewnia odpowiednią wentylację i usuwa szkodliwe opary z miejsca pracy.
- Środki ochrony osobistej: Zawsze noście okulary ochronne, aby chronić oczy przed zachlapaniem, rękawice ochronne (najlepiej nitrylowe) do ochrony skóry rąk oraz fartuch laboratoryjny, który zabezpieczy ubranie przed chemikaliami.
- Bezpieczne obchodzenie się ze stężonym kwasem siarkowym: Jest to silnie żrący kwas, który powoduje poważne poparzenia. Zawsze dodawajcie go kroplami do mieszaniny, nigdy odwrotnie, i zawsze chłodźcie naczynie, aby kontrolować egzotermiczną reakcję.
- Ostrzeżenie przed łatwopalnością i nieprzyjemnymi zapachami: Alkohole i estry są często lotne i łatwopalne. Nigdy nie pracujcie w pobliżu otwartego ognia. Ponadto, niektóre kwasy karboksylowe, takie jak kwas masłowy, mają bardzo intensywny i nieprzyjemny zapach, który może utrzymywać się w laboratorium, dlatego praca pod wyciągiem jest tu podwójnie ważna.
- Utylizacja odpadów: Po zakończeniu eksperymentu nie wylewajcie chemikaliów do zlewu. Odpady organiczne i kwaśne muszą być zbierane do odpowiednio oznakowanych pojemników i utylizowane zgodnie z przepisami. Pamiętajcie o odpowiedzialności za środowisko!
Unikaj błędów i rozwiąż problemy w syntezie estrów
Nawet doświadczonym chemikom zdarzają się pomyłki, a początkujący mogą napotkać pewne trudności. Z mojej praktyki wiem, że najczęstsze problemy w syntezie estrów wynikają z kilku powtarzających się błędów. Ważne jest, aby umieć je zidentyfikować i skorygować, aby osiągnąć sukces w eksperymencie. Nie zrażajcie się, jeśli coś nie wyjdzie za pierwszym razem to część nauki!
- Potencjalne przyczyny niezajścia reakcji: Jeśli po zakończeniu procedury nie wyczuwacie zapachu estru, a jedynie substratów, przyczyn może być kilka. Najczęściej jest to brak lub zbyt mała ilość katalizatora (stężonego kwasu siarkowego), zbyt niska temperatura reakcji (niewystarczające ogrzewanie pod chłodnicą zwrotną) lub zbyt krótki czas reakcji. Upewnijcie się, że wszystkie warunki zostały spełnione zgodnie z instrukcją.
- Co oznacza, gdy produkt ma wciąż nieprzyjemny zapach: Jeśli po izolacji i oczyszczaniu produkt nadal ma ostry, nieprzyjemny zapach (np. octowy, jeśli używaliście kwasu octowego, lub charakterystyczny dla kwasu masłowego), oznacza to zazwyczaj obecność nieprzereagowanego kwasu karboksylowego lub, rzadziej, alkoholu. Oznacza to, że proces oczyszczania był niewystarczający lub reakcja nie zaszła w pełni. W takim przypadku warto powtórzyć przemywanie roztworem wodorowęglanu sodu, aby zneutralizować resztki kwasu.
- Jak poprawić niską wydajność reakcji: Niska wydajność to częsty problem w reakcjach równowagowych. Aby ją poprawić, możecie zastosować większy nadmiar jednego z substratów (zazwyczaj alkoholu), wydłużyć czas reakcji lub spróbować usunąć wodę ze środowiska reakcji (choć to wymaga bardziej zaawansowanego sprzętu, np. pułapki Deana-Starka). Pamiętajcie, że estryfikacja Fischera rzadko daje 100% wydajności, ale zawsze dążymy do jak najlepszego rezultatu.

