Jako doświadczony korepetytor i pasjonat chemii, często widzę, jak uczniowie zmagają się z tworzeniem wzorów sumarycznych soli. To bywa prawdziwa pięta achillesowa, która potrafi zniechęcić do dalszej nauki. Na szczęście istnieje prosta i niezwykle skuteczna technika, którą nazywamy metodą krzyżową. To prawdziwy game changer, który pozwala w mgnieniu oka ustalić poprawny wzór, bez zbędnego zgadywania czy skomplikowanych obliczeń. Dzięki niej chemia staje się o wiele bardziej przystępna, a Ty zyskujesz pewność, że Twoje wzory są zawsze prawidłowe.
- Metoda krzyżowa to mnemotechnika ułatwiająca ustalanie wzorów sumarycznych związków dwupierwiastkowych i soli.
- Kluczem do jej stosowania jest znajomość wartościowości kationu metalu i anionu reszty kwasowej.
- Proces obejmuje zapisanie symboli, określenie wartościowości, przeniesienie ich "na krzyż" jako indeksów, a następnie uproszczenie.
- Wieloatomowe reszty kwasowe z indeksem większym niż 1 zawsze umieszcza się w nawiasie.
- Pozwala uniknąć częstych błędów i jest fundamentalnym narzędziem na wczesnych etapach nauki chemii.

Metoda na krzyż: Twój klucz do chemicznych wzorów
Metoda krzyżowa, którą zaraz Ci przedstawię, to nic innego jak sprytna mnemotechnika czyli technika ułatwiająca zapamiętywanie i stosowanie pewnych zasad. W chemii nie opisuje ona natury wiązań czy skomplikowanych mechanizmów, ale jest praktycznym algorytmem, który pozwala szybko i bezbłędnie ustalić wzory sumaryczne soli. Jej skuteczność tkwi w prostocie i powtarzalności raz opanowana, staje się niezawodnym narzędziem, które oszczędza czas i frustrację.
Czym jest ta metoda i dlaczego ułatwia życie?
Jak wspomniałem, metoda krzyżowa to praktyczny algorytm. Działa jak przepis kulinarny: wykonujesz konkretne kroki w określonej kolejności i zawsze otrzymujesz poprawny wynik. Dla uczniów oznacza to koniec zgadywania, ile atomów danego pierwiastka powinno znaleźć się we wzorze. Zamiast tego, bazujesz na logicznych zasadach wartościowości, co sprawia, że tworzenie wzorów staje się intuicyjne i znacznie mniej stresujące. To naprawdę ułatwia życie, zwłaszcza gdy masz do czynienia z wieloma różnymi solami.
Kiedy znajomość wzorów soli staje się absolutnie niezbędna?
Umiejętność poprawnego tworzenia wzorów soli jest absolutnie kluczowa na wielu etapach nauki chemii. Będziesz jej potrzebować praktycznie w każdym zadaniu, gdzie pojawiają się sole czy to w obliczeniach stechiometrycznych, czy przy pisaniu równań reakcji chemicznych. Bez prawidłowego wzoru nie jesteś w stanie poprawnie zbilansować reakcji, a to z kolei uniemożliwia dalszą pracę z chemią. To podstawa, bez której trudno o solidne fundamenty i zrozumienie bardziej zaawansowanych zagadnień.
Wartościowość metalu i reszty kwasowej: Podstawy, bez których ani rusz
Zanim zagłębisz się w tajniki metody krzyżowej, musisz opanować jedną, absolutnie fundamentalną kwestię: wartościowość. Bez poprawnego określenia wartościowości zarówno metalu, jak i reszty kwasowej, cała metoda krzyżowa traci sens. To jak budowanie domu bez fundamentów po prostu się nie uda. Dlatego poświęćmy chwilę na zrozumienie, skąd brać te kluczowe informacje.
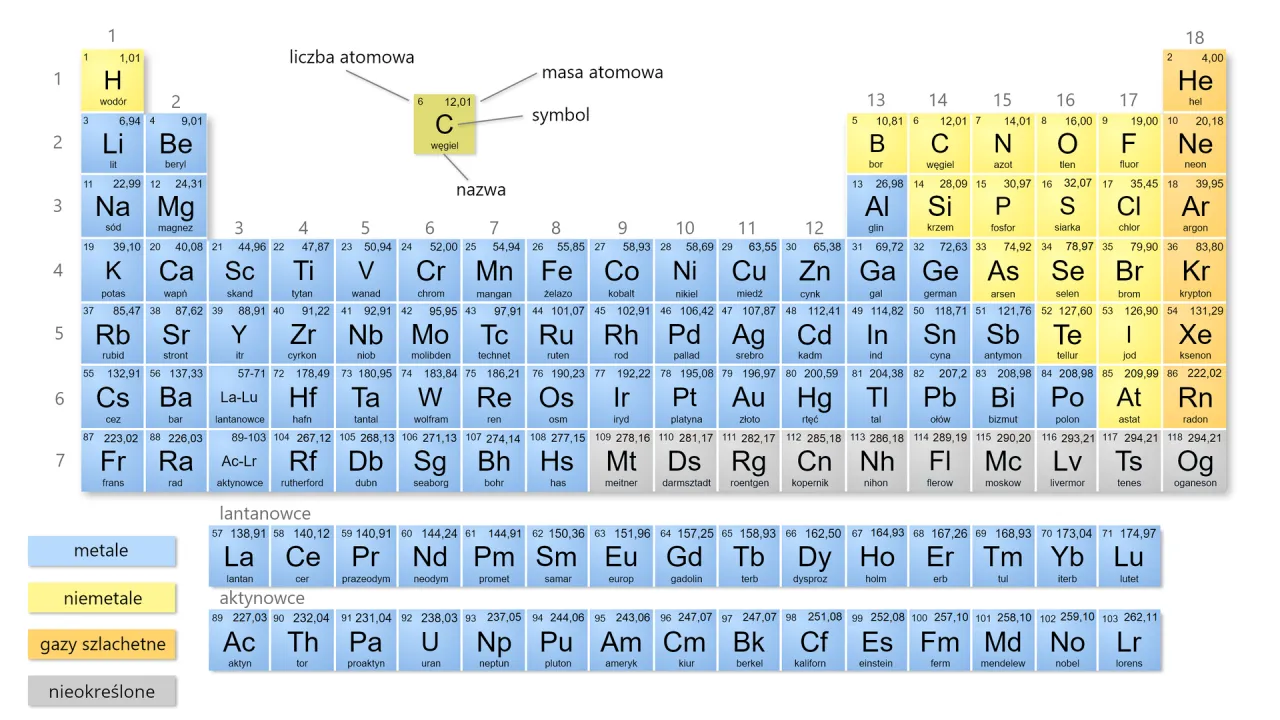
Element #1: Wartościowość metalu jak ją odczytać z układu okresowego?
W przypadku wielu metali, zwłaszcza tych z głównych grup układu okresowego, sprawa jest bardzo prosta. Wartościowość metalu często odpowiada numerowi grupy, w której się znajduje. Na przykład, metale z 1. grupy (np. sód Na, potas K) mają wartościowość I. Metale z 2. grupy (np. magnez Mg, wapń Ca) mają wartościowość II. Podobnie, glin Al z 13. grupy ma wartościowość III. Pamiętaj jednak, że niektóre metale, zwłaszcza te z bloków d i f, mogą mieć zmienną wartościowość, którą zazwyczaj podaje się w nazwie związku (np. żelazo(II) lub żelazo(III)).Element #2: Reszta kwasowa i jej wartościowość skąd wiadomo, jaką ma wartość?
Wartościowość reszty kwasowej jest równie łatwa do ustalenia, jeśli znasz wzór kwasu, od którego ta reszta pochodzi. Otóż wartościowość reszty kwasowej jest równa liczbie atomów wodoru w cząsteczce kwasu. Spójrzmy na przykłady:
- Kwas solny (HCl) ma jeden atom wodoru, więc reszta chlorkowa (Cl⁻) ma wartościowość I.
- Kwas siarkowy(VI) (H₂SO₄) ma dwa atomy wodoru, więc reszta siarczanowa(VI) (SO₄²⁻) ma wartościowość II.
- Kwas fosforowy(V) (H₃PO₄) ma trzy atomy wodoru, więc reszta fosforanowa(V) (PO₄³⁻) ma wartościowość III.
Ściągawka: Tabela najpopularniejszych kationów metali i anionów reszt kwasowych.
Przygotowałem dla Ciebie małą ściągawkę z najczęściej spotykanymi jonami i ich wartościowościami. Warto ją mieć pod ręką na początku nauki!
| Nazwa i symbol/wzór jonu | Wartościowość (cyfra rzymska) |
|---|---|
| Sód (Na⁺) | I |
| Potas (K⁺) | I |
| Magnez (Mg²⁺) | II |
| Wapń (Ca²⁺) | II |
| Glin (Al³⁺) | III |
| Żelazo(II) (Fe²⁺) | II |
| Żelazo(III) (Fe³⁺) | III |
| Miedź(I) (Cu⁺) | I |
| Miedź(II) (Cu²⁺) | II |
| Cynk (Zn²⁺) | II |
| Srebro (Ag⁺) | I |
| Chlorek (Cl⁻) | I |
| Bromek (Br⁻) | I |
| Jodek (I⁻) | I |
| Azotan(V) (NO₃⁻) | I |
| Siarczan(VI) (SO₄²⁻) | II |
| Węglan (CO₃²⁻) | II |
| Fosforan(V) (PO₄³⁻) | III |
| Siarczek (S²⁻) | II |
Metoda krzyżowa krok po kroku: Od teorii do perfekcyjnego wzoru
Teraz, gdy masz już solidne podstawy dotyczące wartościowości, możemy przejść do sedna, czyli do praktycznego zastosowania metody krzyżowej. Przedstawię Ci każdy krok w jasny i zrozumiały sposób, tak abyś bez problemu mógł samodzielnie tworzyć wzory soli.
Krok 1: Zapisz bohaterów symbol metalu i wzór reszty kwasowej
Pierwszy krok jest bardzo prosty: zapisz symbol metalu i wzór reszty kwasowej obok siebie. Na tym etapie nie przejmuj się jeszcze wartościowościami czy indeksami. Po prostu umieść je obok siebie, tak jakbyś przygotowywał składniki do przepisu. Na przykład, jeśli chcesz utworzyć wzór chlorku sodu, zapiszesz: Na Cl.
Krok 2: Ujawnij ich moc określenie i zapisanie wartościowości
Następnie, nad każdym symbolem lub wzorem, zapisz jego wartościowość. Możesz używać cyfr rzymskich lub arabskich ważne, żeby było to czytelne. Wartościowość metalu odczytujesz z układu okresowego (lub z nazwy, jeśli jest zmienna), a reszty kwasowej z liczby wodorów w kwasie. Dla naszego chlorku sodu (Na Cl) będzie to: Naᴵ Clᴵ (sód z 1. grupy ma wartościowość I, a reszta chlorkowa z HCl ma wartościowość I).
Krok 3: Czas na krzyżowanie! Jak przenieść wartościowości, by stały się indeksami?
To jest właśnie ten "krzyżowy" moment! Wartościowość metalu przenosisz "na krzyż" i zapisujesz ją jako indeks dolny przy reszcie kwasowej. Analogicznie, wartościowość reszty kwasowej przenosisz "na krzyż" i zapisujesz jako indeks dolny przy metalu. Pamiętaj o jednej ważnej zasadzie: indeksu "1" nigdy nie zapisujemy. W przypadku Naᴵ Clᴵ, wartościowość I sodu idzie do chloru, a wartościowość I chloru do sodu. Ponieważ obie to jedynki, nie zapisujemy ich, co daje nam wzór: NaCl.
Krok 4: Wielkie porządki kiedy i jak upraszczać (skracać) indeksy?
Po przeniesieniu wartościowości "na krzyż", musisz sprawdzić, czy indeksy dolne mają wspólny dzielnik. Jeśli tak, musisz je uprościć, czyli podzielić przez ten wspólny dzielnik. Jest to obowiązkowe i kluczowe dla uzyskania poprawnego, ostatecznego wzoru. Na przykład, jeśli po krzyżowaniu otrzymałbyś wzór Ca₂S₂, to widzisz, że oba indeksy (2 i 2) mają wspólny dzielnik (2). Dzieląc je przez 2, otrzymasz: CaS. To jest poprawny wzór siarczku wapnia.
Krok 5: Nawias najważniejszy przyjaciel złożonej reszty kwasowej
Ten krok jest niezwykle ważny i często bywa pomijany, prowadząc do błędów. Jeśli reszta kwasowa jest wieloatomowa (czyli składa się z więcej niż jednego atomu, np. SO₄, NO₃, PO₄) i po przeniesieniu wartościowości "na krzyż" jej indeks jest większy niż 1, to musisz całą resztę kwasową umieścić w nawiasie, a indeks zapisać za nawiasem. To kluczowe dla poprawności wzoru, ponieważ indeks odnosi się do całej reszty, a nie tylko do ostatniego atomu. Na przykład, jeśli masz resztę SO₄ z indeksem 3, zapiszesz: (SO₄)₃, a nie SO₄₃.
Metoda krzyżowa w praktyce: Przykłady, które rozwieją wątpliwości
Teoria to jedno, ale jak to bywa w chemii, najlepszym sposobem na opanowanie nowej umiejętności jest przećwiczenie jej na konkretnych przykładach. Pokażę Ci teraz kilka typowych sytuacji, abyś zobaczył, jak metoda krzyżowa działa w praktyce.
Przykład prosty: Tworzymy wzór chlorku glinu (AlCl₃)
Zacznijmy od czegoś prostego, ale z różnymi wartościowościami. Chcemy utworzyć wzór chlorku glinu.
- Krok 1: Zapisz symbole. Mamy glin (Al) i resztę chlorkową (Cl). Zapisujemy: Al Cl.
- Krok 2: Określ wartościowości. Glin (Al) jest w 13. grupie, więc ma wartościowość III. Reszta chlorkowa (Cl) pochodzi od HCl, więc ma wartościowość I. Zapisujemy: Alᴵᴵᴵ Clᴵ.
- Krok 3: Przenieś wartościowości "na krzyż". Wartościowość III glinu idzie do chloru, a wartościowość I chloru idzie do glinu.
- Krok 4: Uprość indeksy (jeśli to możliwe). Otrzymujemy Al₁Cl₃. Indeksu "1" nie zapisujemy.
- Krok 5: Nawias (niepotrzebny). Reszta chlorkowa jest jednoatomowa, więc nawias jest zbędny.
Ostateczny wzór to: AlCl₃. Proste, prawda?
Przykład z upraszczaniem: Jak powstaje wzór siarczku magnezu (MgS)?
Teraz przykład, który wymaga uproszczenia. Utwórzmy wzór siarczku magnezu.
- Krok 1: Zapisz symbole. Mamy magnez (Mg) i resztę siarczkową (S). Zapisujemy: Mg S.
- Krok 2: Określ wartościowości. Magnez (Mg) jest w 2. grupie, więc ma wartościowość II. Reszta siarczkowa (S) pochodzi od H₂S, więc ma wartościowość II. Zapisujemy: Mgᴵᴵ Sᴵᴵ.
- Krok 3: Przenieś wartościowości "na krzyż". Wartościowość II magnezu idzie do siarki, a wartościowość II siarki idzie do magnezu. Otrzymujemy: Mg₂S₂.
- Krok 4: Uprość indeksy. Oba indeksy (2 i 2) mają wspólny dzielnik (2). Dzielimy je przez 2.
- Krok 5: Nawias (niepotrzebny). Reszta siarczkowa jest jednoatomowa.
Po uproszczeniu otrzymujemy wzór: MgS. Pamiętaj, upraszczanie jest obowiązkowe!
Przykład z nawiasem: Ustalanie wzoru siarczanu(VI) żelaza(III) (Fe₂(SO₄)₃)
To już nieco bardziej złożony przykład, gdzie pojawi się nawias. Tworzymy wzór siarczanu(VI) żelaza(III).
- Krok 1: Zapisz symbole. Mamy żelazo (Fe) i resztę siarczanową(VI) (SO₄). Zapisujemy: Fe SO₄.
- Krok 2: Określ wartościowości. Z nazwy wiemy, że żelazo ma wartościowość III. Reszta siarczanowa(VI) (SO₄) pochodzi od H₂SO₄, więc ma wartościowość II. Zapisujemy: Feᴵᴵᴵ (SO₄)ᴵᴵ.
- Krok 3: Przenieś wartościowości "na krzyż". Wartościowość III żelaza idzie do reszty siarczanowej, a wartościowość II reszty siarczanowej idzie do żelaza. Otrzymujemy: Fe₂(SO₄)₃.
- Krok 4: Uprość indeksy (niepotrzebne). Indeksy 2 i 3 nie mają wspólnego dzielnika.
- Krok 5: Nawias. Reszta siarczanowa (SO₄) jest wieloatomowa, a jej indeks (3) jest większy niż 1. Dlatego całą resztę umieszczamy w nawiasie.
Ostateczny wzór to: Fe₂(SO₄)₃. Bez nawiasu byłoby Fe₂SO₄₃, co jest błędem!
Przykład dla zaawansowanych: Tworzenie wzoru fosforanu(V) wapnia (Ca₃(PO₄)₂)
Ostatni przykład, który łączy w sobie wszystko, co do tej pory omówiliśmy. Utwórzmy wzór fosforanu(V) wapnia.
- Krok 1: Zapisz symbole. Mamy wapń (Ca) i resztę fosforanową(V) (PO₄). Zapisujemy: Ca PO₄.
- Krok 2: Określ wartościowości. Wapń (Ca) jest w 2. grupie, więc ma wartościowość II. Reszta fosforanowa(V) (PO₄) pochodzi od H₃PO₄, więc ma wartościowość III. Zapisujemy: Caᴵᴵ (PO₄)ᴵᴵᴵ.
- Krok 3: Przenieś wartościowości "na krzyż". Wartościowość II wapnia idzie do reszty fosforanowej, a wartościowość III reszty fosforanowej idzie do wapnia. Otrzymujemy: Ca₃(PO₄)₂.
- Krok 4: Uprość indeksy (niepotrzebne). Indeksy 3 i 2 nie mają wspólnego dzielnika.
- Krok 5: Nawias. Reszta fosforanowa (PO₄) jest wieloatomowa, a jej indeks (2) jest większy niż 1. Zatem umieszczamy ją w nawiasie.
Ostateczny wzór to: Ca₃(PO₄)₂. Widzisz, że z każdym kolejnym przykładem staje się to coraz bardziej intuicyjne.
Unikaj typowych błędów: Pułapki metody krzyżowej
Metoda krzyżowa jest prosta, ale jak każda technika, ma swoje pułapki. Znajomość najczęstszych błędów pozwoli Ci ich unikać i zawsze uzyskiwać poprawne wyniki. W końcu po to tu jestem, żeby Cię przed nimi ostrzec!
Pułapka #1: Mylenie wartościowości metalu z jego masą atomową
To bardzo częsty błąd, zwłaszcza na początku nauki. Wartościowość to "moc łączenia" atomu, czyli liczba wiązań, które może utworzyć. Masa atomowa to po prostu waga atomu. To są dwie zupełnie różne rzeczy! Wartościowość odczytujemy z numeru grupy (dla metali głównych) lub jest podana w nazwie. Masa atomowa jest zawsze w układzie okresowym pod symbolem pierwiastka. Nigdy ich nie myl!
Pułapka #2: "Zgubiony" nawias przy resztach kwasowych klasyczny błąd
Brak nawiasu przy wieloatomowych resztach kwasowych, gdy ich indeks jest większy niż 1, to chyba najczęściej popełniany błąd. Jeśli masz resztę azotanową (NO₃) i jej indeks wynosi 2, to poprawny zapis to Mg(NO₃)₂. Zapis MgNO₃₂ jest błędny, ponieważ sugeruje, że tylko atom tlenu jest wzięty dwa razy, a nie cała reszta azotanowa. Pamiętaj: jeśli reszta kwasowa ma więcej niż jeden atom i jej indeks jest większy niż 1, ZAWSZE użyj nawiasu!
Przeczytaj również: Chemia dla dzieci: 5 bezpiecznych eksperymentów z kuchni!
Pułapka #3: Strach przed skracaniem, czyli kiedy upraszczanie jest obowiązkowe
Niektórzy uczniowie boją się skracać indeksy, myśląc, że zmieni to wzór. Pamiętaj, że upraszczanie indeksów jest obowiązkowe, jeśli mają wspólny dzielnik! Wzór Ca₂S₂ jest niepoprawny, ponieważ można go uprościć do CaS. Pozostawienie nieskróconego wzoru jest traktowane jako błąd. To jak powiedzenie "dwa plus dwa równa się cztery" i zapisanie "2+2=4" zamiast po prostu "4". Zawsze dążymy do najprostszej formy.

