Cząsteczka wody, choć na pierwszy rzut oka wydaje się prosta, kryje w sobie niezwykłą właściwość jest dipolem. To właśnie ta cecha, wynikająca z jej specyficznej budowy i rozkładu ładunków, stanowi fundament dla wszystkich unikalnych właściwości wody, które są absolutnie kluczowe dla istnienia życia na Ziemi. Zrozumienie, dlaczego woda jest dipolem i jakie ma to konsekwencje, pozwoli nam docenić jej niezastąpioną rolę w przyrodzie i w naszych organizmach.
Woda to dipol dlaczego jej unikalne właściwości są kluczowe dla życia?
- Cząsteczka wody jest dipolem, co oznacza, że posiada dwa bieguny (dodatni i ujemny) z powodu nierównomiernego rozmieszczenia ładunków elektrycznych, mimo że jest elektrycznie obojętna.
- Polarność wody wynika z wysokiej elektroujemności tlenu, który silniej przyciąga elektrony, oraz z jej kątowej, a nie liniowej, budowy (kąt 104,5°).
- Dipolowy charakter wody umożliwia tworzenie wiązań wodorowych, które są odpowiedzialne za większość jej niezwykłych właściwości.
- Woda jest doskonałym rozpuszczalnikiem dla substancji polarnych i jonowych, co jest kluczowe dla procesów biologicznych i chemicznych.
- Wiązania wodorowe odpowiadają za zjawiska kohezji, adhezji, wysokie napięcie powierzchniowe oraz anomalię gęstości lodu, który unosi się na wodzie, chroniąc życie w zbiornikach.
- Wysokie ciepło właściwe i ciepło parowania wody, również wynikające z jej dipolowej natury, stabilizują klimat i regulują temperaturę organizmów.
Czym jest dipol i dlaczego jego zrozumienie jest kluczowe?
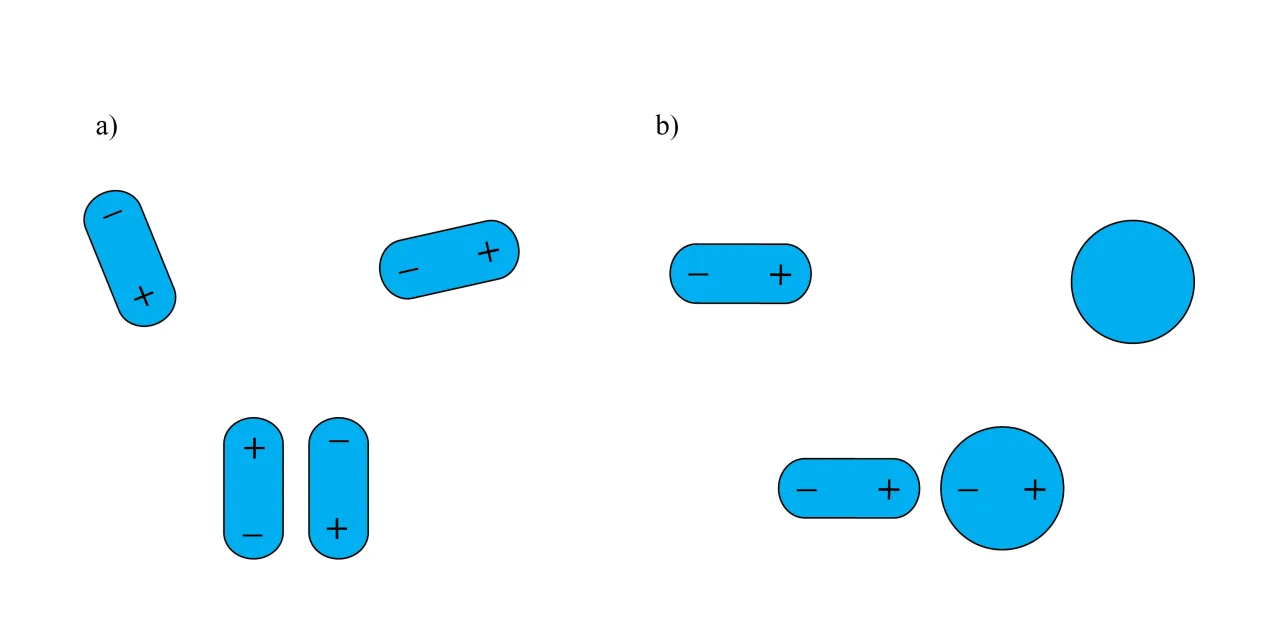
Zacznijmy od podstaw: czym właściwie jest dipol? W chemii, dipol to cząsteczka, która, mimo że jako całość jest elektrycznie obojętna, posiada dwa wyraźne bieguny jeden dodatni i jeden ujemny. Dzieje się tak z powodu nierównomiernego rozmieszczenia cząstkowych ładunków elektrycznych w jej obrębie. Zrozumienie tego zjawiska jest absolutnie kluczowe, ponieważ to właśnie ono warunkuje większość niezwykłych właściwości wody, które są niezbędne dla życia.Dwa bieguny w jednej cząsteczce jak to możliwe?
Może wydawać się to paradoksalne, że coś elektrycznie obojętnego może mieć bieguny, ale to właśnie sedno sprawy. Wyobraźmy sobie, że elektrony w cząsteczce nie są rozłożone równomiernie. Zamiast tego, z jakiegoś powodu, skupiają się bardziej w jednej części cząsteczki, nadając jej charakter cząstkowo ujemny, podczas gdy inna część staje się cząstkowo dodatnia. To nierównomierne rozmieszczenie ładunków, nawet jeśli suma wszystkich ładunków wynosi zero, tworzy te dwa bieguny, działające jak miniaturowe magnesy. W przypadku wody, ta zasada ma fundamentalne znaczenie.
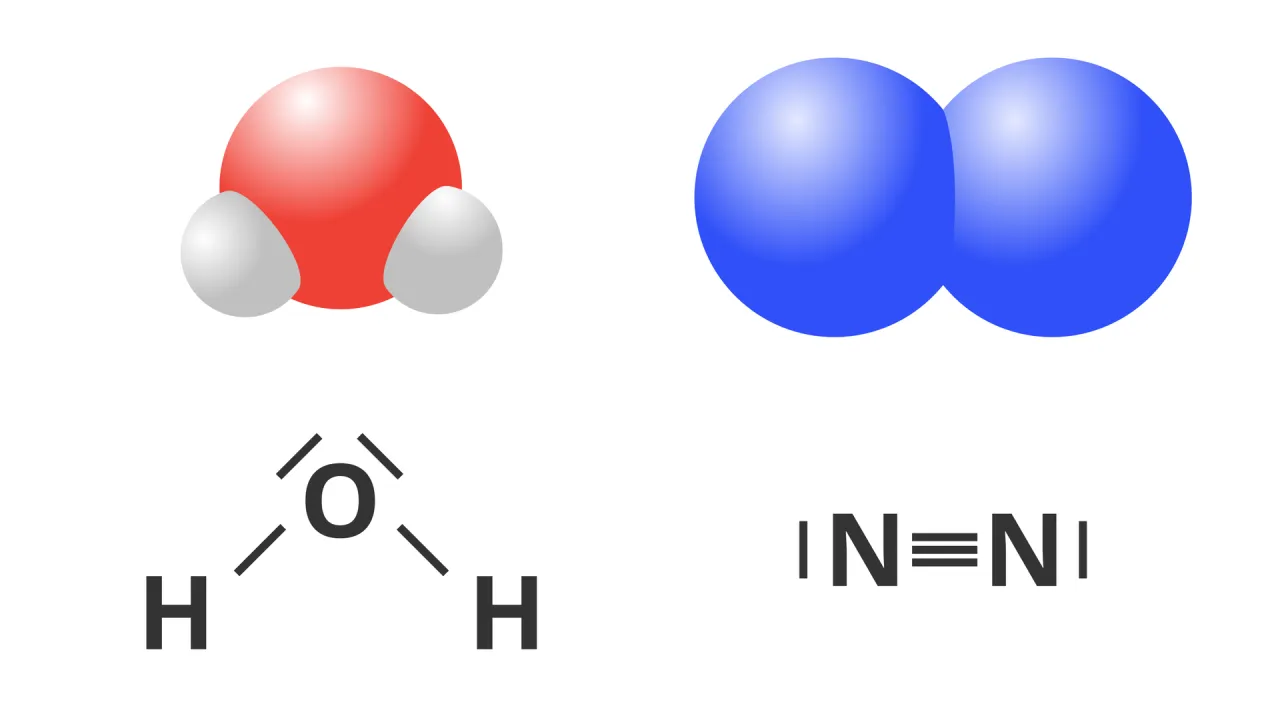
Anatomia cząsteczki wody: odkryj sekret jej dipolowej natury
Cząsteczka wody, oznaczana jako H₂O, składa się z jednego atomu tlenu (O) i dwóch atomów wodoru (H). Te atomy są połączone ze sobą za pomocą wiązań kowalencyjnych. Na pierwszy rzut oka, to prosta struktura, ale to właśnie w jej szczegółach kryje się sekret polarności. To, jak te atomy są ze sobą połączone i jak są rozmieszczone w przestrzeni, jest kluczem do zrozumienia, dlaczego woda jest dipolem.
Nierówna walka o elektrony: rola potężnej elektroujemności tlenu
Kluczowym pojęciem, które musimy zrozumieć, jest elektroujemność. To nic innego jak zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. W przypadku wody, tlen jest znacznie bardziej elektroujemny niż wodór. Co to oznacza w praktyce? Oznacza to, że elektrony tworzące wiązania kowalencyjne między tlenem a wodorem spędzają znacznie więcej czasu w pobliżu atomu tlenu. W efekcie, atom tlenu zyskuje cząstkowy ładunek ujemny (δ-), ponieważ elektrony są do niego silniej przyciągane. Z kolei atomy wodoru, "pozbawione" części elektronów, stają się cząstkowo dodatnie (δ+). To właśnie ten nierówny podział elektronów jest pierwszym krokiem do utworzenia dipola.
Geometria, która zmienia wszystko: dlaczego kąt 104,5° jest tak istotny?
Sama elektroujemność tlenu nie wystarczyłaby do uczynienia wody dipolem, gdyby cząsteczka miała budowę liniową, tak jak na przykład dwutlenek węgla (CO₂). Woda ma jednak kątową (zgiętą) budowę, z kątem około 104,5° między wiązaniami H-O-H. Ta asymetryczna geometria jest absolutnie niezbędna! Gdyby cząsteczka była liniowa, cząstkowe ładunki dodatnie na wodorach znajdowałyby się po przeciwnych stronach atomu tlenu, a ich "siły" by się znosiły. Dzięki kątowej budowie, ładunki dodatnie na wodorach są skierowane w jedną stronę, a ładunek ujemny na tlenie w inną, co tworzy wyraźny moment dipolowy. To właśnie ta kombinacja spolaryzowanych wiązań i asymetrycznej geometrii sprawia, że woda jest tak silnym dipolem.Mapa ładunków w cząsteczce wody: gdzie jest plus, a gdzie minus?
Podsumowując, na atomie tlenu w cząsteczce wody gromadzi się cząstkowy ładunek ujemny (δ-), podczas gdy na obu atomach wodoru znajdują się cząstkowe ładunki dodatnie (δ+). To tworzy wyraźne dwa bieguny elektryczne w jednej cząsteczce. Możemy to sobie wyobrazić jako mały magnes, gdzie jeden koniec jest lekko ujemny, a drugi lekko dodatni. To właśnie ta "mapa ładunków" jest odpowiedzialna za wszystkie niezwykłe właściwości wody, które omówimy w kolejnej sekcji.
Spektakularne konsekwencje: jak dipolowa natura wody kształtuje świat?
Zrozumienie, dlaczego woda jest dipolem, to dopiero początek. Prawdziwa fascynacja zaczyna się, gdy uświadomimy sobie, jak ta fundamentalna właściwość przekłada się na jej codzienne zachowania i dlaczego bez niej życie, jakie znamy, byłoby niemożliwe. Teraz zagłębimy się w praktyczne i fundamentalne konsekwencje dipolowego charakteru wody dla jej właściwości.
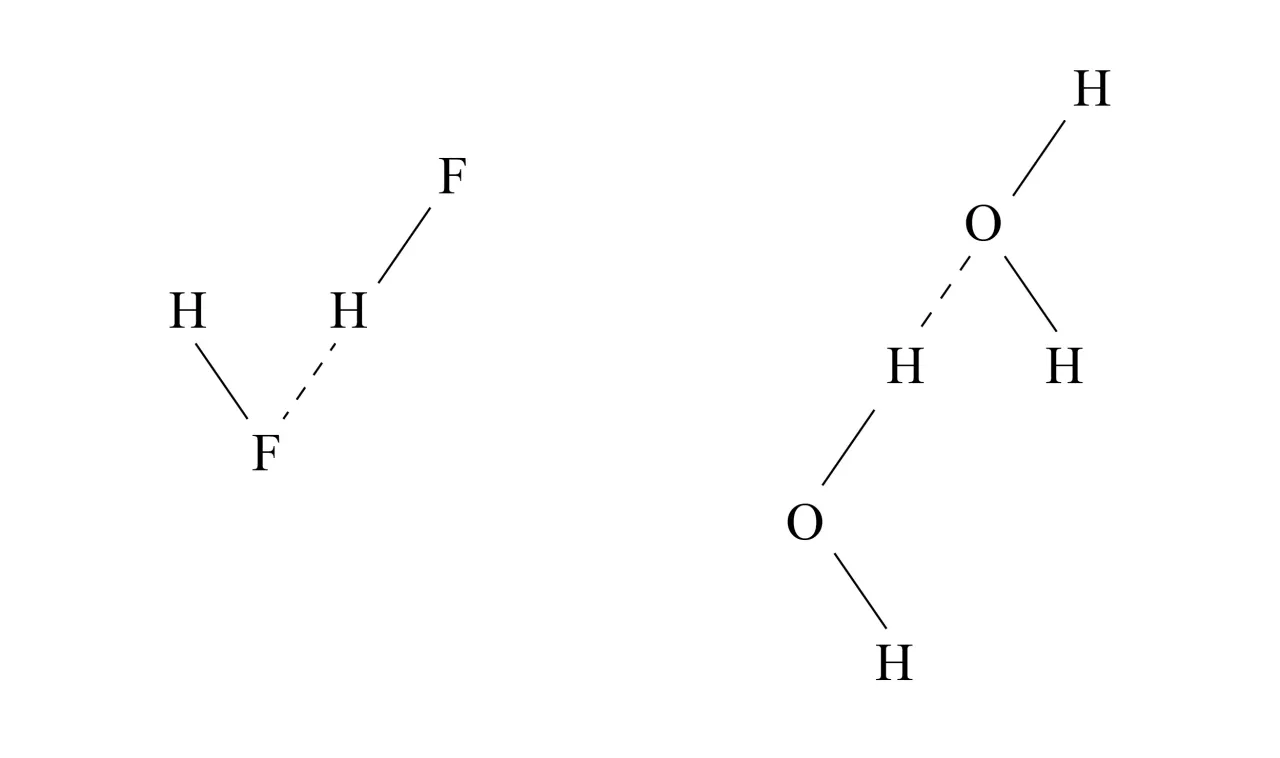
Niewidzialna siła, która łączy: jak dipole tworzą wiązania wodorowe?
Ponieważ cząsteczki wody są dipolami, naturalnie przyciągają się wzajemnie. Dodatnio naładowany atom wodoru jednej cząsteczki wody jest silnie przyciągany przez ujemnie naładowany atom tlenu innej cząsteczki wody. To specyficzne oddziaływanie nazywamy wiązaniem wodorowym. Chociaż pojedyncze wiązanie wodorowe jest znacznie słabsze niż wiązanie kowalencyjne wewnątrz cząsteczki wody, to w masie wody tworzy się ich ogromna liczba. To właśnie ta rozległa sieć wiązań wodorowych jest odpowiedzialna za większość unikalnych właściwości wody, od jej wysokiej temperatury wrzenia po zdolność do rozpuszczania wielu substancji.
„Podobne rozpuszcza podobne”: woda jako uniwersalny rozpuszczalnik życia
Jedną z najbardziej znanych właściwości wody jest jej zdolność do rozpuszczania wielu substancji. Dzieje się tak właśnie dzięki jej dipolowej naturze. Woda jest doskonałym rozpuszczalnikiem dla substancji polarnych (takich jak cukry, alkohole) oraz jonowych (jak sole). Cząsteczki wody, ze swoimi dodatnimi i ujemnymi biegunami, otaczają jony lub polarne cząsteczki rozpuszczanej substancji, tworząc tak zwaną powłokę hydratacyjną. To neutralizuje przyciąganie między cząsteczkami rozpuszczanej substancji i pozwala im swobodnie rozproszyć się w roztworze. Z tego samego powodu substancje niepolarne, takie jak tłuszcze czy oleje, nie rozpuszczają się w wodzie brakuje im ładunków, z którymi dipolowe cząsteczki wody mogłyby oddziaływać.
Magnesy w mikroskali: sekret kohezji, adhezji i niezwykłego napięcia powierzchniowego
Wiązania wodorowe sprawiają, że cząsteczki wody silnie przyciągają się nawzajem to zjawisko nazywamy kohezją. To właśnie kohezja odpowiada za wysokie napięcie powierzchniowe wody, które pozwala małym owadom, takim jak nartniki, utrzymywać się na jej powierzchni. Widziałem to wiele razy nad stawami i zawsze mnie to fascynuje! Ponadto, woda ma zdolność przylegania do innych powierzchni, co nazywamy adhezją. Połączenie kohezji i adhezji jest kluczowe dla zjawiska kapilarnego, które umożliwia wodzie podciąganie się w górę w wąskich naczyniach, co jest niezbędne dla transportu wody w roślinach od korzeni aż po najwyższe liście.
Wpływ dipolowej natury wody na globalne zjawiska i życie
Nie tylko na poziomie mikro, ale i makro, dipolowa natura wody ma kolosalne znaczenie. Jej właściwości wpływają na globalne zjawiska klimatyczne i są fundamentalne dla istnienia i przetrwania życia na Ziemi. Przyjrzyjmy się bliżej tym globalnym konsekwencjom.

Anomalia, która chroni życie: dlaczego lód jest lżejszy od wody?
Większość substancji w stanie stałym jest gęstsza niż w stanie ciekłym, co oznacza, że toną w swojej płynnej formie. Woda jest jednak chlubnym wyjątkiem lód jest lżejszy od wody w stanie ciekłym i unosi się na niej. To zjawisko nazywamy anomalią gęstości wody. Dlaczego tak się dzieje? Kiedy woda zamarza, jej cząsteczki, dzięki wiązaniom wodorowym, układają się w bardziej otwartą, krystaliczną sieć, która zajmuje więcej miejsca niż w stanie ciekłym. Ta luźniejsza struktura sprawia, że lód ma mniejszą gęstość. Ta anomalia jest absolutnie kluczowa dla życia: lód tworzy izolującą warstwę na powierzchni zbiorników wodnych, chroniąc organizmy żyjące pod spodem przed zamarznięciem. Bez tego, rzeki i jeziora zamarzałyby od dna, niszcząc życie wodne.
Naturalny termostat planety: rola wysokiego ciepła właściwego
Kolejną niezwykłą właściwością wody, wynikającą z jej dipolowej natury i wiązań wodorowych, jest jej wysokie ciepło właściwe. Oznacza to, że potrzeba dużej ilości energii, aby podnieść temperaturę wody. Podobnie, woda ma wysokie ciepło parowania potrzeba dużo energii, aby zamienić ją w parę. Dlaczego? Ponieważ aby zmienić temperaturę wody lub doprowadzić do jej parowania, trzeba najpierw zerwać liczne wiązania wodorowe, co pochłania znaczną energię. Te właściwości sprawiają, że woda działa jak naturalny termostat, stabilizując klimat na Ziemi. Duże masy wodne, takie jak oceany, pochłaniają i uwalniają ogromne ilości ciepła, łagodząc wahania temperatury i tworząc stabilne warunki dla życia.
Energia ukryta w parowaniu: jak woda chłodzi organizmy i klimat?
Wysokie ciepło parowania wody ma również bezpośrednie znaczenie dla procesów chłodzenia. Kiedy woda paruje, zabiera ze sobą znaczną ilość energii cieplnej z otoczenia. To zjawisko jest fundamentem dla regulacji temperatury w organizmach żywych na przykład, kiedy się pocimy, parująca woda z naszej skóry skutecznie nas chłodzi. Podobnie, parowanie wody z powierzchni oceanów i lądów odgrywa kluczową rolę w globalnym obiegu energii i regulacji klimatu, przenosząc ciepło z obszarów równikowych w kierunku biegunów.
Woda to nie wszystko: dlaczego substancje niepolarne nie mieszają się z wodą?
Choć woda jest najważniejszym i najbardziej znanym przykładem, warto pamiętać, że istnieją również inne cząsteczki polarne. Jednak to właśnie dipolowa natura wody jest tak wyjątkowa. Zrozumienie zasady "podobne rozpuszcza podobne" jest tutaj kluczowe. Substancje niepolarne, takie jak tłuszcze czy oleje, nie posiadają cząstkowych ładunków, z którymi cząsteczki wody mogłyby tworzyć wiązania wodorowe lub oddziaływania elektrostatyczne. W efekcie, cząsteczki wody wolą oddziaływać ze sobą nawzajem, tworząc zwartą sieć, a substancje niepolarne są z niej "wypychane", co prowadzi do ich rozwarstwiania się. To zjawisko ma ogromne znaczenie biologiczne, na przykład w budowie błon komórkowych, które są właśnie barierami tłuszczowymi oddzielającymi wodne środowiska.
Przeczytaj również: Bisfenol A (BPA): Ukryte zagrożenie i jak chronić swoje zdrowie
Dipol wody: mała właściwość, wielkie znaczenie dla życia
Jak widać, dipolowy charakter cząsteczki wody, wynikający z jej budowy i elektroujemności tlenu, to nie tylko ciekawostka chemiczna. To fundamentalna właściwość, która warunkuje wszystkie jej unikalne cechy od zdolności do tworzenia wiązań wodorowych, przez bycie uniwersalnym rozpuszczalnikiem, aż po anomalię gęstości lodu i wysokie ciepło właściwe. Te właściwości mają kluczowe znaczenie dla istnienia życia na Ziemi i funkcjonowania ziemskich ekosystemów. Bez tej "małej" właściwości, nasz świat wyglądałby zupełnie inaczej, a życie, jakie znamy, prawdopodobnie by nie istniało.

