Jak odróżnić wiązanie kowalencyjne spolaryzowane od niespolaryzowanego klucz do zrozumienia chemii
- Kluczowa metoda: Różnica elektroujemności (ΔE) w skali Paulinga jest podstawą klasyfikacji.
- Wiązanie niespolaryzowane: ΔE w zakresie 0.0-0.4; elektrony są uwspólniane równomiernie.
- Wiązanie spolaryzowane: ΔE powyżej 0.4 do 1.7; elektrony przesunięte w stronę bardziej elektroujemnego atomu, tworząc ładunki cząstkowe (δ+, δ-).
- Wiązanie jonowe: ΔE powyżej 1.7; niemal całkowity transfer elektronów.
- Elektroujemność: Miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym.
- Polarność cząsteczki vs. wiązania: Spolaryzowane wiązania nie zawsze oznaczają polarną cząsteczkę (np. CO₂, CCl₄) ze względu na symetrię.
Wiązanie kowalencyjne, nazywane też atomowym, to nic innego jak uwspólnianie elektronów walencyjnych przez dwa atomy. Dzieje się tak, aby każdy z nich osiągnął stabilną konfigurację elektronową, najczęściej oktet lub dublet, podobną do gazów szlachetnych. To sprytny sposób na osiągnięcie chemicznego spokoju.
Jednak to uwspólnianie nie zawsze jest idealnie równe. Właśnie tutaj pojawia się podział na wiązania kowalencyjne spolaryzowane i niespolaryzowane. Oba typy to wciąż wiązania kowalencyjne, ale różnią się tym, jak symetrycznie rozłożona jest chmura elektronowa wokół łączących się atomów. To kluczowa różnica, która wpływa na właściwości całej cząsteczki.
Elektroujemność w skali Paulinga Twoje narzędzie
Aby skutecznie rozróżniać te wiązania, musimy posłużyć się pojęciem elektroujemności. Jest to nic innego jak miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Im wyższa elektroujemność, tym silniej atom „ciągnie” do siebie elektrony. Najczęściej korzystamy ze skali Paulinga, która przypisuje każdemu pierwiastkowi określoną wartość liczbową.
Wartości elektroujemności dla poszczególnych pierwiastków znajdziesz w układzie okresowym pierwiastków lub w specjalnych tablicach. To właśnie te liczby będą Twoim podstawowym narzędziem do klasyfikacji wiązań. Nie musisz ich pamiętać na pamięć wystarczy wiedzieć, gdzie ich szukać.
Krok po kroku: Jak klasyfikować wiązania kowalencyjne
Teraz przejdźmy do konkretów. Oto prosta instrukcja, jak odróżnić wiązanie kowalencyjne spolaryzowane od niespolaryzowanego, wykorzystując różnicę elektroujemności.Krok 1: Znajdź atomy i ich elektroujemności
Na początek zidentyfikuj dwa atomy, które tworzą wiązanie, które chcesz sklasyfikować. Następnie, korzystając z układu okresowego lub tablic chemicznych, odczytaj wartości ich elektroujemności w skali Paulinga. Zapisz je, aby mieć je pod ręką.
Krok 2: Oblicz różnicę elektroujemności (ΔE)
Oblicz różnicę między tymi dwoma wartościami elektroujemności. Zawsze odejmuj mniejszą wartość od większej, tak aby wynik był zawsze dodatni. Ta różnica, oznaczana jako ΔE (delta E), jest kluczowa dla dalszej klasyfikacji.
Przeczytaj również: Bezpieczna elektroliza wody w domu? Zrób to z sodą oczyszczoną!
Krok 3: Zinterpretuj wynik i sklasyfikuj wiązanie
Teraz nadszedł czas na "złotą regułę" chemii. Na podstawie obliczonej wartości ΔE możesz sklasyfikować wiązanie:
- Jeśli ΔE mieści się w przedziale 0.0 - 0.4, mówimy o wiązaniu kowalencyjnym niespolaryzowanym. Oznacza to, że elektrony są uwspólniane niemal równo.
- Jeśli ΔE jest większe niż 0.4, ale nie przekracza 1.7, mamy do czynienia z wiązaniem kowalencyjnym spolaryzowanym. Elektrony są przesunięte w stronę bardziej elektroujemnego atomu.
- Jeśli ΔE jest większe niż 1.7, to wiązanie ma charakter jonowy. Różnica w przyciąganiu elektronów jest tak duża, że dochodzi do niemal całkowitego transferu elektronu.
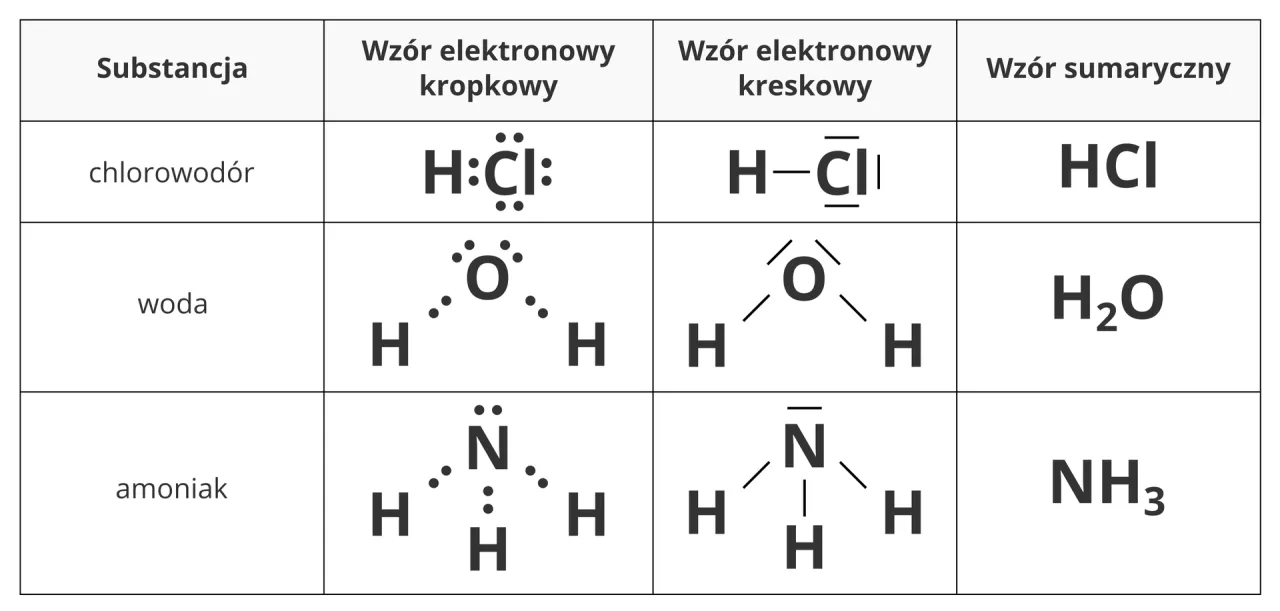
Przykłady zastosowania metody ΔE
Teoria jest ważna, ale to przykłady najlepiej pokazują, jak to działa w praktyce. Spójrzmy na kilka popularnych cząsteczek.
| Cząsteczka | Atomy | Elektroujemność 1 | Elektroujemność 2 | Różnica ΔE | Typ wiązania | Wyjaśnienie |
|---|---|---|---|---|---|---|
| H₂ | H-H | 2.20 (H) | 2.20 (H) | 0.00 | Kowalencyjne niespolaryzowane | Atomy wodoru mają identyczną elektroujemność, więc elektrony są uwspólniane idealnie równo. |
| Cl₂ | Cl-Cl | 3.16 (Cl) | 3.16 (Cl) | 0.00 | Kowalencyjne niespolaryzowane | Podobnie jak w H₂, identyczne atomy chloru dzielą elektrony równomiernie. |
| CH₄ (C-H) | C-H | 2.55 (C) | 2.20 (H) | 0.35 | Kowalencyjne niespolaryzowane | Różnica ΔE jest niewielka (poniżej 0.4), co klasyfikuje wiązanie C-H jako niespolaryzowane. |
| H₂O (O-H) | O-H | 3.44 (O) | 2.20 (H) | 1.24 | Kowalencyjne spolaryzowane | Tlen jest znacznie bardziej elektroujemny niż wodór, co powoduje silne przesunięcie elektronów w jego stronę. |
| HCl (H-Cl) | H-Cl | 3.16 (Cl) | 2.20 (H) | 0.96 | Kowalencyjne spolaryzowane | Chlor silniej przyciąga elektrony niż wodór, tworząc wiązanie spolaryzowane. |
| NaCl | Na-Cl | 0.93 (Na) | 3.16 (Cl) | 2.23 | Jonowe | Bardzo duża różnica elektroujemności prowadzi do niemal całkowitego transferu elektronu z sodu na chlor. |
Polarność wiązania a polarność cząsteczki Ważne rozróżnienie
Kiedy mówimy o wiązaniu spolaryzowanym, oznacza to, że wspólna para elektronowa jest przesunięta w stronę atomu o wyższej elektroujemności. To przesunięcie powoduje powstanie cząstkowych ładunków: na bardziej elektroujemnym atomie pojawia się cząstkowy ładunek ujemny (δ-), a na mniej elektroujemnym cząstkowy ładunek dodatni (δ+). Cząsteczka staje się wtedy dipolem, czyli ma dwa bieguny.
Jednak bardzo ważne jest, aby rozróżnić polarność samego wiązania od polarności całej cząsteczki. Cząsteczka może zawierać wiązania spolaryzowane, ale być niepolarna jako całość! Dzieje się tak, gdy jej budowa jest symetryczna, a momenty dipolowe poszczególnych wiązań wzajemnie się znoszą. Klasycznymi przykładami są dwutlenek węgla (CO₂) czy czterochlorek węgla (CCl₄). W CO₂ wiązania C=O są spolaryzowane, ale liniowa struktura cząsteczki sprawia, że momenty dipolowe znoszą się, a cała cząsteczka jest niepolarna. Podobnie w CCl₄, gdzie tetraedryczna, symetryczna budowa powoduje, że pomimo spolaryzowanych wiązań C-Cl, cząsteczka jest niepolarna.Umowność granic i wyjątki
Warto pamiętać, że wartości progowe, które podałem (0.4 i 1.7), są umowne i służą jako praktyczne wytyczne. W chemii, jak to często bywa, zdarzają się wyjątki. Niektóre związki balansują na granicy tych wartości, a ich klasyfikacja może być przedmiotem dyskusji.
Dobrym przykładem jest fluorowodór (HF), dla którego różnica elektroujemności wynosi aż 1.9. Zgodnie z naszą regułą, sugerowałoby to wiązanie jonowe. Jednakże, ze względu na właściwości fizykochemiczne, HF jest klasyfikowany jako związek z silnie spolaryzowanym wiązaniem kowalencyjnym. To pokazuje, że ostateczną weryfikacją charakteru wiązania są zawsze właściwości chemiczne i fizyczne związku, a reguły oparte na elektroujemności są doskonałym punktem wyjścia, ale nie jedynym kryterium.

