Lód unosi się na wodzie dzięki unikalnej właściwości wody anomalnej rozszerzalności
- Woda osiąga największą gęstość w temperaturze +4°C, a poniżej tej wartości jej gęstość maleje.
- Lód w temperaturze 0°C jest o około 9% mniej gęsty niż woda w stanie ciekłym, co sprawia, że pływa.
- Na poziomie molekularnym, zamarzająca woda tworzy uporządkowaną sieć krystaliczną z pustymi przestrzeniami, zwiększając swoją objętość.
- Zjawisko to jest fundamentalne dla przetrwania organizmów wodnych, ponieważ lód tworzy izolacyjną warstwę na powierzchni zbiorników.
- Anomalna rozszerzalność wody odpowiada za pękające rury zimą oraz proces wietrzenia fizycznego skał.
Anomalna rozszerzalność wody to naprawdę wyjątkowa właściwość fizyczna, która wyróżnia ją spośród większości innych substancji. Z mojego punktu widzenia, jako osoby zafascynowanej fizyką, jest to jeden z najbardziej intrygujących aspektów chemii wody. Definiuje się ją jako zjawisko, w którym woda osiąga swoją największą gęstość w temperaturze około +4°C. Co ciekawe, poniżej tej temperatury, w miarę dalszego ochładzania aż do zamarznięcia w 0°C, jej gęstość maleje, a objętość rośnie. To właśnie ta "anomalia" jest kluczem do zrozumienia, dlaczego lód pływa.
Kiedy woda stygnie od wysokich temperatur, jej gęstość początkowo rośnie, podobnie jak w przypadku większości cieczy. Cząsteczki zbliżają się do siebie, zajmując mniejszą objętość. Jednak po osiągnięciu magicznej bariery +4°C, ten trend się odwraca. Poniżej tej temperatury, zamiast dalszego kurczenia się, woda zaczyna się rozszerzać, a jej gęstość maleje. To jest ten moment, kiedy woda zaczyna "przygotowywać się" do zamarznięcia, zmieniając swoje wewnętrzne ułożenie. Wyobraź sobie, że większość substancji kurczy się i staje się gęstsza, gdy zamarza, a woda robi coś dokładnie odwrotnego.Aby to zobrazować, spójrzmy na konkretne liczby. Woda w temperaturze +4°C ma gęstość około 1000 kg/m³ (czyli 1 g/cm³). Natomiast lód w temperaturze 0°C ma znacznie niższą gęstość, wynoszącą około 917 kg/m³. Ta różnica jest znacząca lód jest o około 9% mniej gęsty niż woda w stanie ciekłym! To właśnie ta mniejsza gęstość jest bezpośrednią i jedyną przyczyną, dla której lód unosi się na powierzchni wody. To proste prawo fizyki, które ma jednak ogromne konsekwencje.
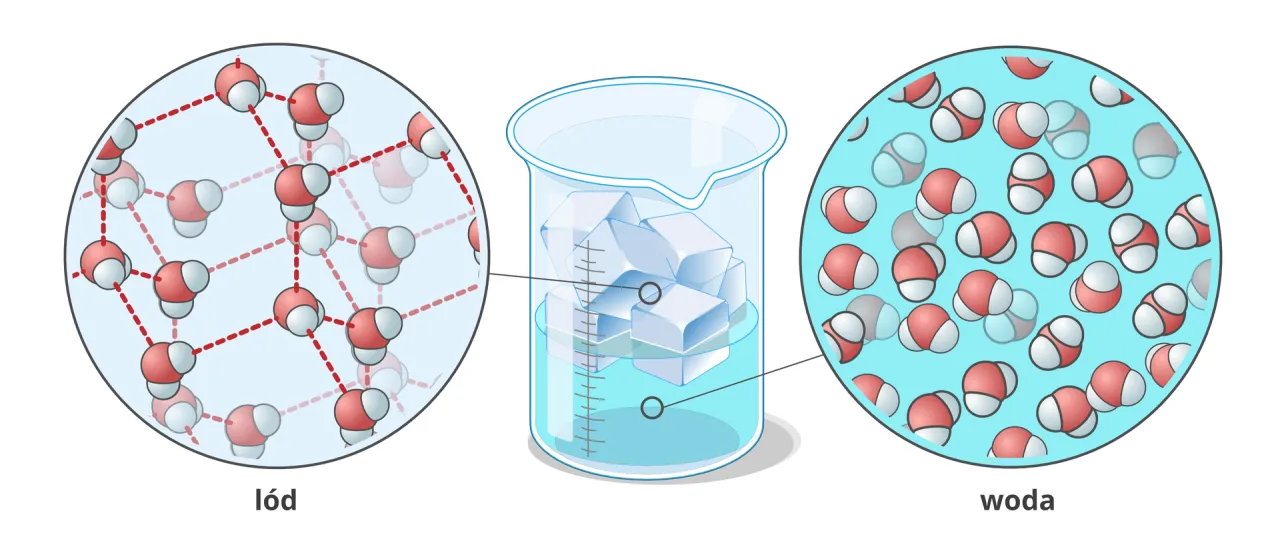
Jak to wygląda od środka? Podróż do świata cząsteczek wody
Aby w pełni zrozumieć, dlaczego lód jest lżejszy od wody, musimy zajrzeć do świata niewidocznych gołym okiem cząsteczek. Kluczową rolę odgrywają tutaj wiązania wodorowe. Woda (H₂O) to cząsteczka polarna, co oznacza, że ma nierównomierny rozkład ładunku, tworząc bieguny dodatnie i ujemne. Dzięki temu cząsteczki wody mogą tworzyć ze sobą wiązania wodorowe słabe, ale liczne oddziaływania, które łączą je w sieć.
W stanie ciekłym cząsteczki wody są ułożone dość chaotycznie i blisko siebie, cały czas się przemieszczając i zrywając oraz tworząc nowe wiązania wodorowe. Kiedy jednak temperatura spada poniżej +4°C, a woda zaczyna zamarzać, wiązania wodorowe stają się silniejsze i bardziej trwałe. Zaczynają one układać cząsteczki H₂O w bardzo regularną, heksagonalną sieć krystaliczną. Jest to struktura znacznie bardziej uporządkowana niż w cieczy.
I tu pojawia się sedno sprawy: ta uporządkowana struktura krystaliczna lodu zawiera w sobie "puste przestrzenie". Cząsteczki wody są w niej rozmieszczone dalej od siebie niż w stanie ciekłym, tworząc rodzaj "rusztowania". W efekcie ta sama masa wody, przechodząc w stan stały, zajmuje większą objętość. Większa objętość przy tej samej masie oznacza oczywiście mniejszą gęstość. To tak, jakbyś budował dom z klocków w stanie ciekłym klocki leżą luzem, a w stanie stałym są ułożone w strukturę z pustymi oknami i drzwiami, zajmując więcej miejsca.
Podsumowując, woda w stanie ciekłym to dynamiczny chaos, gdzie cząsteczki są blisko siebie, ale nie mają stałego ułożenia. W stanie stałym, czyli w lodzie, cząsteczki H₂O są zmuszone do przyjęcia sztywnej, uporządkowanej struktury z regularnie rozmieszczonymi pustymi przestrzeniami. Ta zmiana w ułożeniu cząsteczek, wymuszona przez wiązania wodorowe, jest bezpośrednią przyczyną zwiększenia objętości i spadku gęstości lodu w porównaniu do wody ciekłej.

Anomalia wody: klucz do istnienia życia na Ziemi
Anomalna rozszerzalność wody to nie tylko ciekawy fakt fizyczny; to zjawisko o fundamentalnym znaczeniu dla życia na naszej planecie. Wyobraź sobie, co by się stało, gdyby lód tonął. Ale zanim do tego przejdziemy, przyjrzyjmy się, jak ta właściwość chroni życie. Kiedy temperatura otoczenia spada poniżej zera, zbiorniki wodne, takie jak jeziora czy stawy, zaczynają zamarzać. Jednak dzięki anomalnej rozszerzalności wody, lód tworzy się na powierzchni. Ta warstwa lodu działa jak naturalny izolator, chroniąc głębsze partie wody przed dalszym oziębieniem. Pod lodem, przy dnie, woda utrzymuje stabilną temperaturę około +4°C, czyli tę, w której ma największą gęstość.
Ta warstwa wody o temperaturze +4°C przy dnie jest niczym schronienie dla organizmów wodnych. Ryby, płazy, owady wodne i inne stworzenia mogą przetrwać w niej zimę, prowadząc spowolnioną aktywność życiową. Gdyby woda zamarzała od dna do góry, tak jak większość substancji, życie w zbiornikach wodnych w klimacie umiarkowanym i polarnym byłoby praktycznie niemożliwe. To właśnie dzięki tej anomalii, z każdym nadejściem zimy, ekosystemy wodne mogą przetrwać.
A teraz pomyślmy o tym hipotetycznym scenariuszu: co by się stało, gdyby lód tonął? Gdyby woda zachowywała się jak większość substancji i lód był gęstszy od wody, zamarzałby od dna zbiorników. W miarę spadku temperatury, lód gromadziłby się na dnie, a kolejne warstwy zamarzałyby, aż cały zbiornik, od dna do powierzchni, zamieniłby się w bryłę lodu. Ryby i inne organizmy wodne zostałyby uwięzione i zamarzłyby na śmierć. To doprowadziłoby do katastrofy ekologicznej na niewyobrażalną skalę, eliminując życie w większości słodkowodnych i nawet niektórych słonowodnych ekosystemów na Ziemi. Całe łańcuchy pokarmowe uległyby załamaniu. Zatem, jak widać, ta "anomalia" jest w rzeczywistości błogosławieństwem, które umożliwiło rozwój i przetrwanie życia.
Anomalna rozszerzalność w codziennym życiu
Skutki anomalnej rozszerzalności wody obserwujemy nie tylko w naturze, ale także w naszym codziennym życiu, często w niezbyt przyjemny sposób. Zamarzająca woda jest główną przyczyną pękania rur wodociągowych i grzewczych zimą. Kiedy temperatura spada poniżej zera, woda w rurach zamarza i, jak już wiemy, zwiększa swoją objętość. To zwiększenie objętości generuje ogromne ciśnienie w zamkniętej przestrzeni rury. Ciśnienie to jest tak duże, że potrafi rozsadzić nawet solidne metalowe instalacje, prowadząc do kosztownych awarii i zalania. Dlatego tak ważne jest odpowiednie zabezpieczenie instalacji wodnych przed mrozem.
Innym, równie ważnym, choć często niedocenianym, przykładem działania tej anomalii jest jej rola w wietrzeniu fizycznym skał. Woda wnika w najmniejsze szczeliny i pęknięcia w skałach. Kiedy temperatura spada poniżej zera, woda ta zamarza i zwiększa swoją objętość. To rozszerzanie się wody działa jak klin, rozsadzając skałę od środka. Proces ten powtarza się cyklicznie z każdym zamarzaniem i rozmarzaniem, stopniowo krusząc skały na mniejsze fragmenty. To zjawisko odgrywa kluczową rolę w kształtowaniu krajobrazu, tworząc piargi, rumowiska skalne i przyczyniając się do powstawania gleb.
Na koniec warto odpowiedzieć na często zadawane pytanie: czy inne substancje zachowują się podobnie do wody? Odpowiedź brzmi: nie, woda jest w tym aspekcie wyjątkowa. Większość substancji, zarówno w stanie ciekłym, jak i stałym, kurczy się w miarę obniżania temperatury. Ich stan stały jest zazwyczaj gęstszy niż stan ciekły, dlatego ich "lód" tonie w ich "wodzie". To właśnie ta unikalna cecha wody sprawia, że jest ona tak niezwykła i tak fundamentalna dla istnienia życia, jakie znamy.

