Cześć! Jeśli przygotowujesz się do sprawdzianu z chemii, na którym kalkulator jest zakazany, to doskonale trafiłeś. Wiem z doświadczenia, że umiejętność szybkiego i bezbłędnego obliczania masy molowej związków chemicznych bez wsparcia elektroniki to podstawowa, ale często niedoceniana umiejętność. To nie tylko kwestia zaliczenia, ale też budowania solidnych fundamentów do zrozumienia bardziej złożonych zagadnień chemicznych. Przygotowałem dla Ciebie kompletny przewodnik, który krok po kroku pokaże Ci, jak opanować tę sztukę.
Szybkie obliczanie masy molowej kluczowe zasady dla sprawdzianu bez kalkulatora
- Poznaj zaokrąglone masy atomowe najważniejszych pierwiastków, ponieważ są fundamentem wszystkich obliczeń.
- Postępuj zgodnie z 3-etapową metodą: poprawne czytanie wzoru, mnożenie mas atomowych przez liczbę atomów i sumowanie wyników.
- Zawsze zwracaj uwagę na indeksy stechiometryczne i nawiasy we wzorach chemicznych, gdyż decydują o liczbie atomów.
- Ćwicz na różnorodnych przykładach, aby wyeliminować błędy arytmetyczne i utrwalić metodę.
- Pamiętaj, że brak indeksu przy symbolu pierwiastka oznacza zawsze jeden atom tego pierwiastka.
Obliczanie masy molowej bez kalkulatora: Twój przewodnik do sukcesu na sprawdzianie
Zapewne zastanawiasz się, po co w ogóle uczyć się liczyć masę molową ręcznie, skoro mamy kalkulatory. Otóż, w warunkach szkolnych, na sprawdzianach i kartkówkach, często nie masz dostępu do kalkulatora. Wtedy ta umiejętność staje się nieoceniona. Co więcej, manualne obliczanie wzmacnia Twoje zrozumienie budowy cząsteczki i relacji między atomami, co jest kluczowe dla głębszego pojmowania chemii. To jak nauka tabliczki mnożenia niby można użyć kalkulatora, ale znajomość podstaw przyspiesza i ułatwia wszystko.
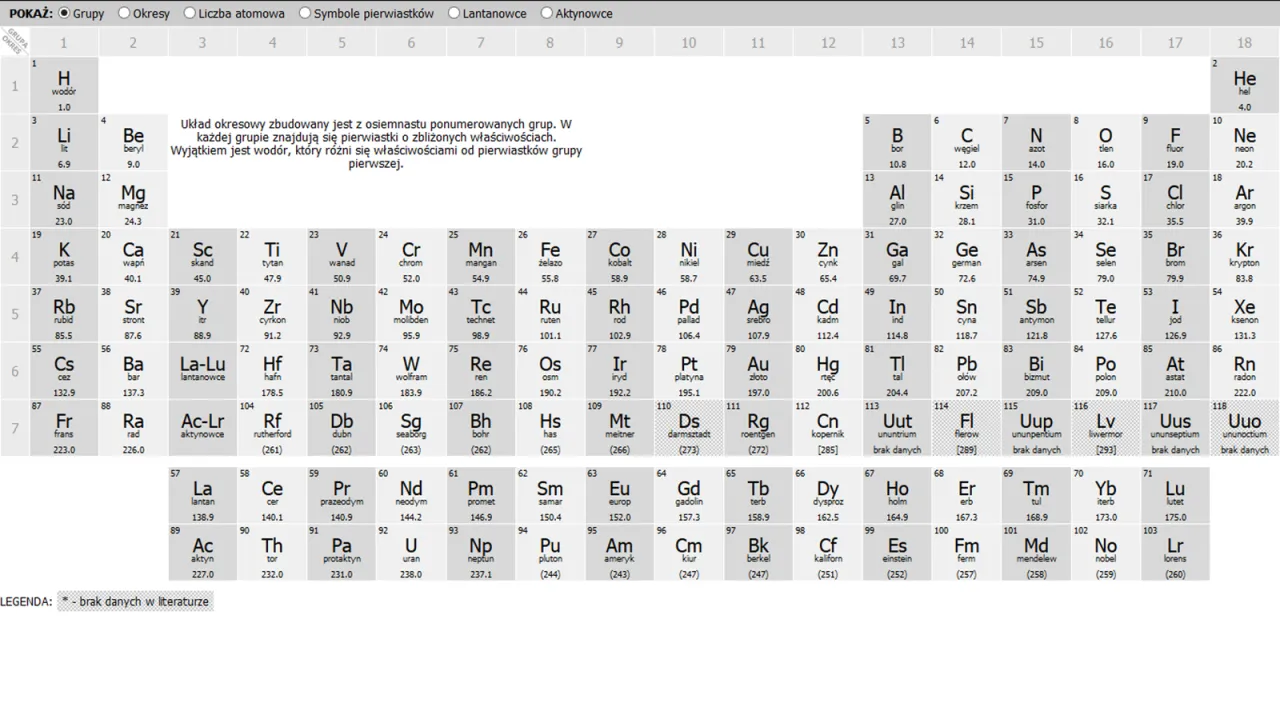
Fundament Twoich obliczeń: skąd brać masy atomowe i które znać na pamięć?
Zanim zaczniemy liczyć, musisz wiedzieć, skąd wziąć masy atomowe. Są one dostępne w układzie okresowym pierwiastków. Jednak na sprawdzianach, gdzie kalkulator jest zabroniony, często musisz znać na pamięć zaokrąglone wartości dla najczęściej występujących pierwiastków. To one stanowią fundament wszystkich Twoich obliczeń. W polskim systemie edukacji przyjęte są pewne standardowe zaokrąglenia, które przedstawiam w poniższej tabeli.
| Pierwiastek (Symbol) | Zaokrąglona masa atomowa (u) |
|---|---|
| Wodór (H) | 1 |
| Węgiel (C) | 12 |
| Azot (N) | 14 |
| Tlen (O) | 16 |
| Sód (Na) | 23 |
| Magnez (Mg) | 24 |
| Glin (Al) | 27 |
| Fosfor (P) | 31 |
| Siarka (S) | 32 |
| Chlor (Cl) | 35,5 |
| Potas (K) | 39 |
| Wapń (Ca) | 40 |
| Żelazo (Fe) | 56 |
| Miedź (Cu) | 63,5 (lub 64) |
Trzy proste kroki do samodzielnego obliczenia masy molowej
Obliczanie masy molowej bez kalkulatora może wydawać się skomplikowane, ale w rzeczywistości sprowadza się do trzech prostych, logicznych kroków. Jeśli opanujesz tę metodykę, żadne zadanie nie będzie dla Ciebie straszne. Przejdźmy przez nie po kolei.
Krok 1: Poprawne "czytanie" wzoru chemicznego klucz do sukcesu
Pierwszym i moim zdaniem najważniejszym krokiem jest dokładne zidentyfikowanie wszystkich pierwiastków wchodzących w skład związku oraz ustalenie, ile atomów każdego z nich znajduje się w cząsteczce. Zwracaj uwagę na małe cyfry, tzw. indeksy stechiometryczne, które znajdują się za symbolem pierwiastka. Na przykład we wzorze H₂O, cyfra "2" przy wodorze oznacza, że są dwa atomy wodoru. Brak cyfry, jak przy tlenie w H₂O, zawsze oznacza jeden atom. Jeśli we wzorze pojawiają się nawiasy, np. w Ca(OH)₂, to indeks poza nawiasem odnosi się do każdego pierwiastka wewnątrz nawiasu. W tym przypadku "2" poza nawiasem oznacza, że mamy dwa atomy tlenu i dwa atomy wodoru.
Krok 2: Mnożenie, czyli jak przypisać masę do każdego atomu w cząsteczce
Gdy już wiesz, ile atomów każdego pierwiastka jest w cząsteczce, przechodzimy do mnożenia. Dla każdego pierwiastka pomnóż liczbę jego atomów przez jego zaokrągloną masę atomową, którą znasz z tabeli lub pamięci. Na przykład, jeśli masz dwa atomy wodoru (H) i wiesz, że masa atomowa wodoru to 1 u, to dla wodoru wykonujesz działanie: 2 * 1 u = 2 u. Ten etap to nic innego jak przygotowanie do finalnego sumowania.
Krok 3: Sumowanie wielki finał Twoich obliczeń
Ostatni krok to zsumowanie wszystkich wyników, które uzyskałeś w kroku drugim. Po prostu dodaj do siebie masy wszystkich pierwiastków. Wynik, który otrzymasz, będzie masą cząsteczkową wyrażoną w unitach (u). Pamiętaj, że masa molowa (M) wyrażona w gramach na mol (g/mol) jest liczbowo równa masie cząsteczkowej wyrażonej w unitach (u). Czyli jeśli masa cząsteczkowa wody to 18 u, to jej masa molowa wynosi 18 g/mol. To jest Twój końcowy wynik!
Masa molowa w praktyce: Przykłady od podstaw do wyzwań
Teoria to jedno, ale prawdziwe zrozumienie przychodzi z praktyką. Przygotowałem dla Ciebie szereg przykładów o różnym stopniu trudności, abyś mógł przećwiczyć każdy aspekt obliczeń. Pamiętaj, że regularne ćwiczenia eliminują błędy arytmetyczne i utrwalają metodę.
Przykład dla początkujących: Obliczamy masę molową wody (H₂O) i tlenku węgla(IV) (CO₂)
Zacznijmy od czegoś prostego. Woda (H₂O): Mamy 2 atomy wodoru (H) i 1 atom tlenu (O). Masa H = 1 u, masa O = 16 u. Obliczenia: (2 * 1 u) + (1 * 16 u) = 2 u + 16 u = 18 u. Zatem masa molowa M(H₂O) = 18 g/mol.
Teraz tlenek węgla(IV) (CO₂): Mamy 1 atom węgla (C) i 2 atomy tlenu (O). Masa C = 12 u, masa O = 16 u. Obliczenia: (1 * 12 u) + (2 * 16 u) = 12 u + 32 u = 44 u. Zatem masa molowa M(CO₂) = 44 g/mol.
Poziom średniozaawansowany: Rozprawiamy się z kwasem siarkowym(VI) (H₂SO₄)
Kwas siarkowy(VI) (H₂SO₄) to już nieco bardziej złożony wzór, ale zasady pozostają te same. Mamy 2 atomy wodoru (H), 1 atom siarki (S) i 4 atomy tlenu (O). Masa H = 1 u, masa S = 32 u, masa O = 16 u. Obliczenia: (2 * 1 u) + (1 * 32 u) + (4 * 16 u) = 2 u + 32 u + 64 u = 98 u. Zatem masa molowa M(H₂SO₄) = 98 g/mol.
Jak nie wpaść w pułapkę? Obliczenia dla związków z nawiasami na przykładzie Ca(OH)₂
Wodorotlenek wapnia (Ca(OH)₂) to klasyczny przykład, gdzie pojawiają się nawiasy. To tutaj wielu uczniów popełnia błędy. Mamy 1 atom wapnia (Ca). Indeks "2" poza nawiasem odnosi się do wszystkiego w nawiasie, czyli do tlenu i wodoru. Zatem mamy 2 atomy tlenu (O) i 2 atomy wodoru (H). Masa Ca = 40 u, masa O = 16 u, masa H = 1 u. Obliczenia: (1 * 40 u) + (2 * 16 u) + (2 * 1 u) = 40 u + 32 u + 2 u = 74 u. Alternatywnie, można najpierw policzyć masę grupy OH: (16 u + 1 u) = 17 u, a następnie pomnożyć ją przez 2: 2 * 17 u = 34 u. Wtedy całość to: 40 u + 34 u = 74 u. Zatem masa molowa M(Ca(OH)₂) = 74 g/mol. Pamiętaj, indeks poza nawiasem mnoży każdy atom wewnątrz nawiasu!
Wyzwanie dla mistrza: Obliczamy masę molową siarczanu(VI) glinu Al₂(SO₄)₃
Siarczan(VI) glinu (Al₂(SO₄)₃) to już prawdziwe wyzwanie, ale z moimi wskazówkami dasz radę! Mamy 2 atomy glinu (Al). Indeks "3" poza nawiasem odnosi się do całej grupy SO₄. Wewnątrz nawiasu mamy 1 atom siarki (S) i 4 atomy tlenu (O). Zatem łącznie mamy 3 atomy siarki (3 * 1 = 3) i 12 atomów tlenu (3 * 4 = 12). Masa Al = 27 u, masa S = 32 u, masa O = 16 u. Obliczenia: (2 * 27 u) + (3 * 32 u) + (12 * 16 u) = 54 u + 96 u + 192 u = 342 u. Zatem masa molowa M(Al₂(SO₄)₃) = 342 g/mol. Widzisz? Nawet skomplikowane wzory stają się proste, gdy rozłożysz je na czynniki pierwsze!
Unikaj tych błędów: Najczęstsze pułapki w obliczeniach masy molowej
Nawet najlepsi popełniają błędy, zwłaszcza pod presją czasu na sprawdzianie. Z mojego doświadczenia wiem, że pewne pułapki pojawiają się nagminnie. Znając je, możesz świadomie ich unikać i ratować cenne punkty.
Pułapka nr 1: Niewidzialna "jedynka", czyli co oznacza brak indeksu przy symbolu
To jeden z najczęstszych błędów! Wielu uczniów zakłada, że brak indeksu stechiometrycznego przy symbolu pierwiastka oznacza, że tego pierwiastka w ogóle nie ma lub jest go zero. To błędne myślenie! Pamiętaj, że brak indeksu zawsze oznacza jeden atom danego pierwiastka. Na przykład, we wzorze H₂O, przy symbolu tlenu (O) nie ma żadnej cyfry, co oznacza, że w cząsteczce wody znajduje się jeden atom tlenu, a nie zero. Zawsze traktuj to jako "1".
Pułapka nr 2: Groźne nawiasy jak poprawnie wymnożyć ich zawartość?
Nawiasy to kolejna pułapka, która potrafi pokrzyżować plany. Indeks za nawiasem (np. "2" w Ca(OH)₂) odnosi się do każdego pierwiastka wewnątrz nawiasu. To znaczy, że jeśli w nawiasie masz (OH)₂, to masz dwa atomy tlenu i dwa atomy wodoru, a nie tylko dwa atomy wodoru. Często widzę, jak uczniowie mnożą tylko ostatni pierwiastek w nawiasie przez indeks, zapominając o pozostałych. Zawsze rozpisz sobie dokładnie, ile atomów każdego pierwiastka masz w cząsteczce po uwzględnieniu nawiasów.
Pułapka nr 3: Pomyłki w tabliczce mnożenia jak zachować koncentrację i liczyć bezbłędnie
Wydaje się banalne, ale błędy arytmetyczne to plaga! Przy dłuższych obliczeniach, zwłaszcza pod presją czasu, łatwo o pomyłkę w dodawaniu czy mnożeniu. Moja rada: rozpisuj każdy krok bardzo dokładnie. Nie staraj się liczyć zbyt wiele w pamięci, jeśli nie masz pewności. Zapisz sobie wszystkie iloczyny, a dopiero potem je zsumuj. Sprawdź dwukrotnie dodawanie, zwłaszcza jeśli liczby są duże. Czasem lepiej poświęcić dodatkowe 30 sekund na sprawdzenie, niż stracić punkty za prosty błąd.
Masy atomowe, które musisz znać: Twoja podręczna ściągawka
Na koniec, aby ułatwić Ci przygotowania, zebrałem najważniejsze masy atomowe, które moim zdaniem każdy uczeń powinien mieć w małym palcu. To Twoja podręczna ściągawka, która pomoże Ci na każdym sprawdzianie.
Lista TOP 10 pierwiastków i ich zaokrąglonych mas atomowych
- Wodór (H): 1 u
- Węgiel (C): 12 u
- Azot (N): 14 u
- Tlen (O): 16 u
- Sód (Na): 23 u
- Magnez (Mg): 24 u
- Glin (Al): 27 u
- Fosfor (P): 31 u
- Siarka (S): 32 u
- Chlor (Cl): 35,5 u
- Potas (K): 39 u
- Wapń (Ca): 40 u
Przeczytaj również: Wulkan z sody i octu: Złote proporcje 1:10 do idealnej erupcji!
Kiedy 35, a kiedy 35,5? O wyjątkach, na które trzeba uważać (np. chlor)
Większość mas atomowych zaokrąglamy do pełnych liczb, ale są pewne wyjątki, które musisz znać. Najważniejszym z nich jest chlor (Cl), którego masa atomowa wynosi 35,5 u. Zawsze używaj tej wartości, chyba że nauczyciel wyraźnie wskaże inaczej. Innym często spotykanym wyjątkiem jest miedź (Cu), której masa atomowa to 63,5 u. Czasami w zadaniach bywa zaokrąglana do 64 u, ale standardowo przyjmuje się 63,5 u. Zawsze zwracaj uwagę na to, czy w treści zadania lub na tablicy podane są specyficzne zaokrąglenia dla tych pierwiastków. Jeśli nie, trzymaj się tych "połówkowych" wartości.

