Zrozumienie różnicy między roztworem nasyconym a nienasyconym to jeden z fundamentów chemii, który ma zaskakująco wiele zastosowań w naszym codziennym życiu. Od parzenia herbaty, przez przygotowywanie syropów, aż po procesy przemysłowe wszędzie tam spotykamy się z pojęciem limitu rozpuszczalności. Właśnie dlatego tak ważne jest, aby klarownie zdefiniować te pojęcia i pokazać ich praktyczny wymiar.
Roztwór nasycony i nienasycony klucz do zrozumienia limitów rozpuszczalności
- Roztwór nienasycony to taki, w którym można jeszcze rozpuścić dodatkową ilość substancji.
- Roztwór nasycony osiągnął maksymalne stężenie substancji rozpuszczonej w danych warunkach; dalsze dodawanie powoduje wytrącanie osadu.
- Kluczową rolę odgrywa rozpuszczalność, czyli maksymalna ilość substancji, która może się rozpuścić.
- Temperatura znacząco wpływa na rozpuszczalność: dla większości ciał stałych rośnie wraz z temperaturą, dla gazów maleje.
- Istnieje też niestabilny roztwór przesycony, zawierający więcej substancji niż wynika z rozpuszczalności, który łatwo krystalizuje.
- Praktyczne przykłady znajdziesz w kuchni, np. podczas słodzenia herbaty.
Definicja dla początkujących: Co to znaczy, że roztwór jest "pełny"?
Wyobraź sobie szklankę wody jako "pojemnik" na cukier. Roztwór nienasycony to taki, w którym ten pojemnik nie jest jeszcze pełny. Oznacza to, że w danej temperaturze i pod danym ciśnieniem można jeszcze rozpuścić dodatkową ilość substancji. Stężenie substancji rozpuszczonej jest w nim niższe niż maksymalne możliwe.
Natomiast roztwór nasycony to ten, w którym nasz "pojemnik" jest już całkowicie wypełniony. W takiej sytuacji w danej temperaturze i pod danym ciśnieniem nie można już rozpuścić więcej substancji. Osiągnięto w nim maksymalne możliwe stężenie substancji rozpuszczonej, a dalsze jej dodawanie spowoduje, że po prostu osiądzie ona na dnie w postaci osadu.Kluczowe pojęcie: Czym jest rozpuszczalność i dlaczego decyduje o wszystkim?
Aby w pełni zrozumieć różnicę między roztworem nasyconym a nienasyconym, musimy najpierw zająć się pojęciem rozpuszczalności. Rozpuszczalność to nic innego jak maksymalna ilość danej substancji (na przykład soli lub cukru), która może rozpuścić się w określonej ilości rozpuszczalnika (najczęściej wody) w konkretnych warunkach temperatury i ciśnienia. To właśnie ta wartość jest kluczowa decyduje o tym, ile "miejsca" na substancję rozpuszczoną jest w naszym rozpuszczalniku i czy roztwór jest "pełny", czy też nie.
Roztwór nienasycony: kiedy wciąż jest miejsce na więcej substancji?
Jak go rozpoznać? Charakterystyczne cechy roztworu nienasyconego
Roztwór nienasycony jest najczęściej spotykanym typem roztworu w codziennym życiu. Jego główną cechą jest to, że dodanie do niego niewielkiej ilości substancji rozpuszczonej spowoduje jej całkowite rozpuszczenie. W roztworze nienasyconym nie zaobserwujemy żadnego osadu na dnie naczynia, ponieważ cała dodana substancja została wchłonięta przez rozpuszczalnik. Można powiedzieć, że roztwór ma jeszcze "apetyt" na więcej.
Przykład z Twojej kuchni: Słodzenie herbaty jako idealna ilustracja
Doskonałym przykładem roztworu nienasyconego jest moment, kiedy słodzisz herbatę jedną łyżeczką cukru. Cukier natychmiast się rozpuszcza, prawda? Nie widzisz żadnych kryształków na dnie filiżanki. To dlatego, że herbata (woda) wciąż ma "pojemność" na przyjęcie większej ilości cukru, zanim osiągnie swój limit. Możesz śmiało dodać kolejną łyżeczkę, a prawdopodobnie i ona się rozpuści.
Od nienasyconego do nasyconego: Jak krok po kroku "dopełnić" roztwór?
Proces "dopełniania" roztworu nienasyconego do stanu nasycenia jest prosty. Wystarczy stopniowo dodawać substancję rozpuszczoną, mieszając ją dokładnie, aż do momentu, w którym kolejna, nawet niewielka ilość, przestanie się rozpuszczać i zacznie osadzać się na dnie. W tym punkcie osiągnęliśmy limit rozpuszczalności dla danych warunków.
Roztwór nasycony: moment, w którym osiągamy limit
Główne cechy: Po czym poznasz, że roztwór osiągnął swój limit?
Roztwór nasycony to stan, w którym rozpuszczalnik nie jest już w stanie przyjąć ani grama więcej substancji rozpuszczonej w danych warunkach temperatury i ciśnienia. Główną cechą, po której go rozpoznasz, jest to, że każda dodatkowa ilość substancji, którą spróbujesz do niego dodać, pozostanie nierozpuszczona. Zamiast zniknąć, osiądzie ona na dnie naczynia w postaci osadu lub kryształków.
Co się stanie, gdy dodasz więcej substancji? Zjawisko wytrącania osadu
Kiedy do roztworu nasyconego dodamy więcej substancji rozpuszczonej, nie ma ona już miejsca, aby się rozpuścić. W efekcie zaobserwujemy zjawisko wytrącania się osadu. Oznacza to, że nadmiar substancji po prostu opadnie na dno naczynia w postaci stałej. To wyraźny sygnał, że roztwór osiągnął swoje maksymalne stężenie i nie jest w stanie przyjąć więcej cząsteczek substancji rozpuszczonej do swojej struktury.
Równowaga dynamiczna: Niewidoczny proces w sercu nasycenia
W roztworze nasyconym, mimo widocznego osadu na dnie, zachodzi fascynujący, choć niewidoczny proces, który nazywamy równowagą dynamiczną. Oznacza to, że cząsteczki substancji z osadu nieustannie rozpuszczają się w roztworze, ale jednocześnie taka sama liczba cząsteczek z roztworu krystalizuje się i wraca do osadu. Oba procesy zachodzą z taką samą szybkością, dlatego stężenie roztworu wydaje się stałe, a ilość osadu nie zmienia się.
Temperatura i ciśnienie: jak zmieniają reguły rozpuszczalności?
Jak ogrzewanie i chłodzenie wpływa na "pojemność" roztworu?
Temperatura ma ogromny wpływ na rozpuszczalność substancji. Dla większości substancji stałych, takich jak cukier czy sól, rozpuszczalność w cieczach rośnie wraz ze wzrostem temperatury. Oznacza to, że podgrzewając roztwór nienasycony, możemy rozpuścić w nim znacznie więcej substancji. Z kolei ochładzając gorący roztwór nasycony, możemy doprowadzić do wytrącenia się kryształów, czyli krystalizacji.
W przypadku gazów zależność jest odwrotna ich rozpuszczalność maleje ze wzrostem temperatury. Dlatego też, gdy woda w akwarium jest zbyt ciepła, ryby mogą mieć problem z oddychaniem, ponieważ tlen (gaz) słabiej się w niej rozpuszcza.
Czy gazy rozpuszczają się inaczej? Odwrotna zależność, o której musisz wiedzieć
Tak, gazy zachowują się nieco inaczej niż ciała stałe. Ich rozpuszczalność maleje wraz ze wzrostem temperatury, ale co ciekawe, rośnie wraz ze wzrostem ciśnienia. To dlatego napoje gazowane, takie jak cola czy woda mineralna, są butelkowane pod ciśnieniem pozwala to na rozpuszczenie większej ilości dwutlenku węgla. Kiedy otwieramy butelkę, ciśnienie spada, a gaz zaczyna uwalniać się w postaci bąbelków.
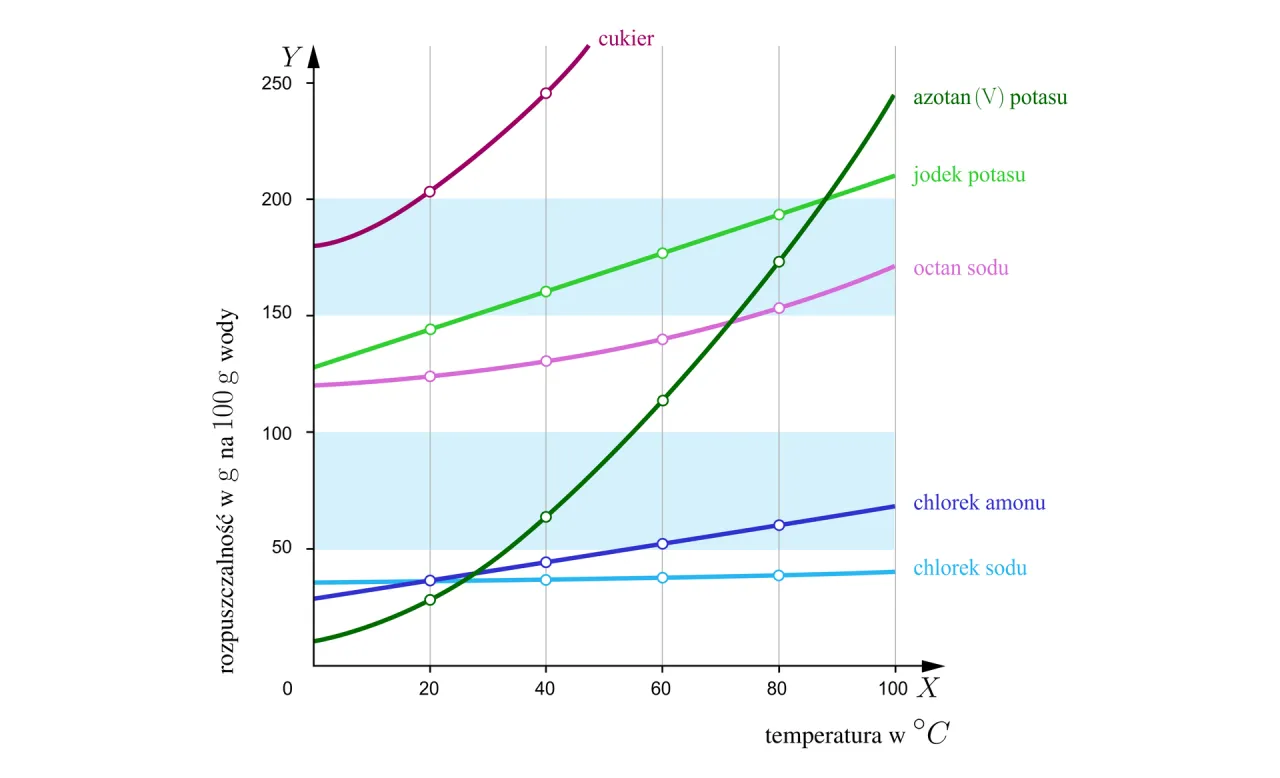
Wizualizacja problemu: Jak czytać krzywe rozpuszczalności?
Krzywa rozpuszczalności to niezwykle przydatne narzędzie graficzne, które przedstawia zależność rozpuszczalności danej substancji od temperatury. Na osi poziomej zazwyczaj mamy temperaturę, a na osi pionowej rozpuszczalność (np. w gramach substancji na 100 g wody). Dzięki takiej krzywej możemy łatwo odczytać, ile gramów cukru, soli kuchennej (NaCl) czy innych substancji rozpuści się w danej ilości wody w konkretnej temperaturze, a tym samym określić, czy roztwór jest nasycony, czy nienasycony. Punkt na krzywej oznacza stan nasycenia, obszar poniżej krzywej roztwór nienasycony, a obszar powyżej przesycony.
Roztwór przesycony: co się dzieje, gdy przekroczymy limit?
Niestabilny stan materii: Jak stworzyć roztwór przesycony?
Roztwór przesycony to fascynujący, ale jednocześnie niestabilny stan materii. Zawiera on więcej substancji rozpuszczonej, niż wynikałoby to z jej rozpuszczalności w danej temperaturze. Jak to możliwe? Możemy go uzyskać, na przykład, przez przygotowanie gorącego, nasyconego roztworu, a następnie bardzo powolne i ostrożne chłodzenie go, unikając wszelkich wstrząsów czy zanieczyszczeń. Roztwór taki jest jak "bomba zegarowa" czeka na najmniejszy impuls, aby uwolnić nadmiar substancji.
Efekt domina: Czym jest krystalizacja i dlaczego jest tak widowiskowa?
Kiedy roztwór przesycony zostanie zaburzony na przykład przez dodanie małego kryształka substancji, wstrząśnięcie naczyniem, a nawet drobinkę kurzu następuje gwałtowna krystalizacja nadmiaru substancji. To zjawisko jest często nazywane "efektem domina", ponieważ jeden mały impuls wywołuje lawinę tworzących się kryształów, które szybko rosną, aż do momentu, gdy roztwór osiągnie stan nasycenia. Jest to proces niezwykle widowiskowy i wykorzystywany w produkcji na przykład miodu sztucznego czy lizaków, gdzie gorący, nasycony syrop cukrowy jest powoli chłodzony, a następnie inicjowana jest krystalizacja.
Kluczowe różnice: roztwór nasycony i nienasycony w pigułce
Tabela porównawcza: Nasycony vs. Nienasycony zestawienie kluczowych cech
Aby jeszcze lepiej utrwalić różnice, przygotowałem krótkie zestawienie kluczowych cech obu typów roztworów:
| Cecha | Roztwór Nienasycony | Roztwór Nasycony |
|---|---|---|
| Ilość substancji rozpuszczonej | Poniżej maksymalnej możliwej | Maksymalna możliwa w danych warunkach |
| Możliwość dalszego rozpuszczania | Tak, można rozpuścić więcej | Nie, nie można rozpuścić więcej |
| Obecność osadu | Brak osadu | Obecny osad nierozpuszczonej substancji |
| Stan równowagi | Brak równowagi dynamicznej | Równowaga dynamiczna (rozpuszczanie = krystalizacja) |
Przeczytaj również: Proszek do pieczenia a soda: Jak wybrać i uniknąć błędów?
Jak ta wiedza przydaje się w praktyce? Od chemii w szkole po codzienne życie
Zrozumienie różnic między roztworami nasyconymi i nienasyconymi to nie tylko teoria z podręcznika chemii. Ta wiedza ma realne zastosowania w wielu aspektach naszego życia. W kuchni pomaga nam w przygotowywaniu idealnych syropów, dżemów czy nawet w słodzeniu napojów. W przemyśle chemicznym jest kluczowa w procesach krystalizacji, oczyszczania substancji czy produkcji leków. Nawet w przyrodzie, na przykład w procesach powstawania minerałów, obserwujemy zjawiska związane z nasyceniem i krystalizacją. To pokazuje, jak fundamentalne i wszechobecne są te pojęcia w otaczającym nas świecie.

