W świecie chemii organicznej, gdzie miliony związków różnią się od siebie subtelnymi niuansami w budowie, umiejętność rysowania i interpretowania wzorów chemicznych jest absolutnie kluczowa. Ten artykuł to Twój praktyczny przewodnik, który krok po kroku wyjaśni, jak poprawnie przedstawiać cząsteczki, od prostych alkanów po związki z grupami funkcyjnymi, pomagając Ci opanować tę fundamentalną umiejętność.
Jak rysować wzory strukturalne i półstrukturalne kluczowe zasady i typowe błędy
- Wzory sumaryczne, strukturalne i półstrukturalne różnią się poziomem szczegółowości, a wzory półstrukturalne są najczęściej używane w chemii organicznej.
- Podstawą poprawnego rysowania jest znajomość wartościowości pierwiastków (C-4, H-1, O-2, N-3) oraz reguły oktetu.
- Proces rysowania obejmuje najpierw ustalenie szkieletu węglowego, a następnie uzupełnienie wiązań i atomów wodoru zgodnie z wartościowością.
- Należy zwracać uwagę na wiązania wielokrotne i prawidłowe grupowanie atomów wodoru oraz grup funkcyjnych.
- Najczęstsze błędy to nieprawidłowa wartościowość atomów, gubienie atomów wodoru oraz błędne łączenie grup funkcyjnych.
- Wzory szkieletowe to dalsze uproszczenie, w którym pomija się atomy węgla i wodoru związane z węglem.
Zrozumieć podstawy: wzory sumaryczne, strukturalne i półstrukturalne
Zanim zagłębimy się w techniki rysowania, musimy zrozumieć, że w chemii używamy różnych typów wzorów, z których każdy dostarcza nam innych informacji o cząsteczce. To trochę jak oglądanie mapy możesz mieć ogólną mapę kraju, szczegółową mapę miasta lub plan konkretnego budynku. Każda z nich jest użyteczna w innym kontekście.
Wzór sumaryczny jest najbardziej podstawowy. Mówi nam jedynie, jakie atomy i w jakiej liczbie wchodzą w skład cząsteczki. Na przykład, wzór sumaryczny C₂H₆O informuje, że cząsteczka zawiera dwa atomy węgla, sześć atomów wodoru i jeden atom tlenu. Jest to jednak informacja niewystarczająca, ponieważ C₂H₆O może reprezentować zarówno etanol (alkohol), jak i eter dimetylowy (eter) dwa zupełnie różne związki o innych właściwościach. Właśnie dlatego wzory sumaryczne są mało przydatne, gdy mówimy o izomerach.
Wzór strukturalny to już znacznie bardziej szczegółowy obraz. Pokazuje on wszystkie atomy w cząsteczce oraz wszystkie wiązania chemiczne między nimi, przedstawione jako kreski. Dzięki niemu widzimy, jak atomy są ze sobą połączone i jakie tworzą grupy. Jest niezwykle dokładny i nie pozostawia żadnych wątpliwości co do budowy cząsteczki. Problem pojawia się jednak przy dużych, złożonych cząsteczkach rysowanie każdego atomu i każdego wiązania staje się wtedy czasochłonne i niepraktyczne, a sam wzór może być mało czytelny.
Wzór półstrukturalny, nazywany również grupowym, to moim zdaniem złoty środek i najczęściej stosowany zapis w chemii organicznej. Jest to kompromis między wzorem sumarycznym a strukturalnym. Pokazuje on wiązania między atomami węgla oraz między węglem a grupami funkcyjnymi, ale upraszcza zapis atomów wodoru. Zamiast rysować każdą kreskę C-H, grupujemy atomy wodoru przy atomie węgla, z którym są związane. Na przykład, etanol, który ma wzór sumaryczny C₂H₆O, we wzorze półstrukturalnym zapiszemy jako CH₃CH₂OH. Widzimy tu wyraźnie grupę metylową (CH₃), grupę metylenową (CH₂) i grupę hydroksylową (OH), co daje nam jasny obraz struktury.
| Typ wzoru | Charakterystyka i zastosowanie |
|---|---|
| Wzór sumaryczny | Podaje tylko rodzaj i liczbę atomów (np. C₂H₆O). Mało informatywny, zwłaszcza dla izomerów. |
| Wzór strukturalny | Przedstawia wszystkie atomy i wszystkie wiązania. Bardzo dokładny, ale niepraktyczny dla dużych cząsteczek. |
| Wzór półstrukturalny (grupowy) | Pokazuje wiązania C-C i C-grupa funkcyjna; wodory grupowane przy węglu (np. CH₃CH₂OH). Najczęściej używany w chemii organicznej. |

Niezbędne zasady rysowania wzorów chemicznych
Aby poprawnie rysować wzory chemiczne, musimy opanować kilka fundamentalnych zasad. To one stanowią szkielet, na którym opiera się cała struktura cząsteczki. Bez ich zrozumienia, łatwo o błędy, które całkowicie zmieniają sens wzoru.
-
Złota reguła wartościowości
To absolutna podstawa! Wartościowość pierwiastka określa, ile wiązań może on utworzyć. W chemii organicznej kluczowe są cztery pierwiastki, a ich wartościowości to: węgiel (C) jest zawsze czterowartościowy (tworzy 4 wiązania), wodór (H) jednowartościowy (1 wiązanie), tlen (O) dwuwartościowy (2 wiązania), a azot (N) trójwartościowy (3 wiązania). Ja nazywam to "regułą 4, 3, 2, 1" i moim zdaniem warto ją zapamiętać na zawsze. Węgiel jest wyjątkowy, ponieważ jego zdolność do tworzenia czterech wiązań z innymi atomami, w tym z innymi atomami węgla, pozwala na budowanie skomplikowanych łańcuchów i pierścieni, co jest podstawą całej chemii organicznej.
-
Zasada oktetu
Atomy dążą do osiągnięcia stabilnej konfiguracji elektronowej, zazwyczaj poprzez posiadanie ośmiu elektronów walencyjnych (tzw. oktet elektronowy). Wyjątkiem jest wodór, który dąży do posiadania dwóch elektronów (dubletu). Tworzenie wiązań chemicznych pozwala atomom "dzielić się" elektronami, aby osiągnąć tę stabilność. Zawsze, gdy rysujesz wzór, upewnij się, że każdy atom (z wyjątkiem wodoru) ma wokół siebie osiem elektronów walencyjnych (cztery wiązania, jeśli nie ma wolnych par elektronowych, lub odpowiednio mniej wiązań, jeśli ma wolne pary).
-
Wiązania pojedyncze, podwójne i potrójne
Liczba kresek między atomami ma ogromne znaczenie. Jedna kreska oznacza wiązanie pojedyncze, dwie kreski wiązanie podwójne, a trzy kreski wiązanie potrójne. Każda kreska "zużywa" jedno miejsce w wartościowości atomu. Na przykład, jeśli węgiel tworzy wiązanie podwójne z innym atomem węgla, to "zużywa" już dwa ze swoich czterech możliwych wiązań, co oznacza, że pozostałe dwa wiązania może utworzyć z innymi atomami (np. dwoma atomami wodoru). Pamiętaj o tym, bo to klucz do prawidłowego uzupełniania atomów wodoru, zwłaszcza w związkach nienasyconych.
Rysowanie wzorów krok po kroku: od prostych do złożonych
Teraz, gdy znamy już podstawowe zasady, przejdźmy do praktyki. Pokażę Ci, jak krok po kroku rysować wzory dla różnych typów związków, zaczynając od najprostszych.
Proste węglowodory nasycone (alkany)
Alkany to najprostsze związki organiczne, składające się tylko z atomów węgla i wodoru, połączonych wiązaniami pojedynczymi. Są świetnym punktem wyjścia do nauki rysowania.
-
Krok 1: Rysujemy pełny wzór strukturalny
Weźmy na przykład propan, który ma wzór sumaryczny C₃H₈. Zaczynamy od narysowania szkieletu węglowego trzech atomów węgla połączonych wiązaniami pojedynczymi: C-C-C. Następnie uzupełniamy wartościowość każdego atomu węgla do czterech, dodając atomy wodoru. Pierwszy węgiel jest połączony z jednym węglem, więc potrzebuje trzech wodorów (CH₃). Środkowy węgiel jest połączony z dwoma węglami, więc potrzebuje dwóch wodorów (CH₂). Ostatni węgiel jest połączony z jednym węglem, więc potrzebuje trzech wodorów (CH₃). Pełny wzór strukturalny wyglądałby tak:
H
|
HCH
|
HCH
|
HCH
|
H -
Krok 2: Grupujemy wodory przy węglach, tworząc wzór półstrukturalny
Teraz, aby przekształcić to we wzór półstrukturalny, grupujemy atomy wodoru przy atomach węgla, z którymi są związane. Zamiast rysować wszystkie kreski C-H, zapisujemy je w nawiasach lub bezpośrednio obok węgla. Dla propanu otrzymamy: CH₃CH₂CH₃. Jak widzisz, jest to znacznie czytelniejsze i szybsze do narysowania.
-
Jak upraszczać długie łańcuchy? Magia nawiasów w praktyce
Dla dłuższych łańcuchów węglowych, takich jak pentan (C₅H₁₂), rysowanie każdego CH₂ jest nużące. W takich przypadkach możemy zastosować zapis skondensowany z nawiasami. Pentan ma wzór półstrukturalny CH₃CH₂CH₂CH₂CH₃. Zauważ, że grupa -CH₂- powtarza się trzykrotnie. Możemy to uprościć do: CH₃(CH₂)₃CH₃. To bardzo praktyczne i powszechnie stosowane uproszczenie, które pozwala na szybkie zapisywanie nawet bardzo długich cząsteczek.
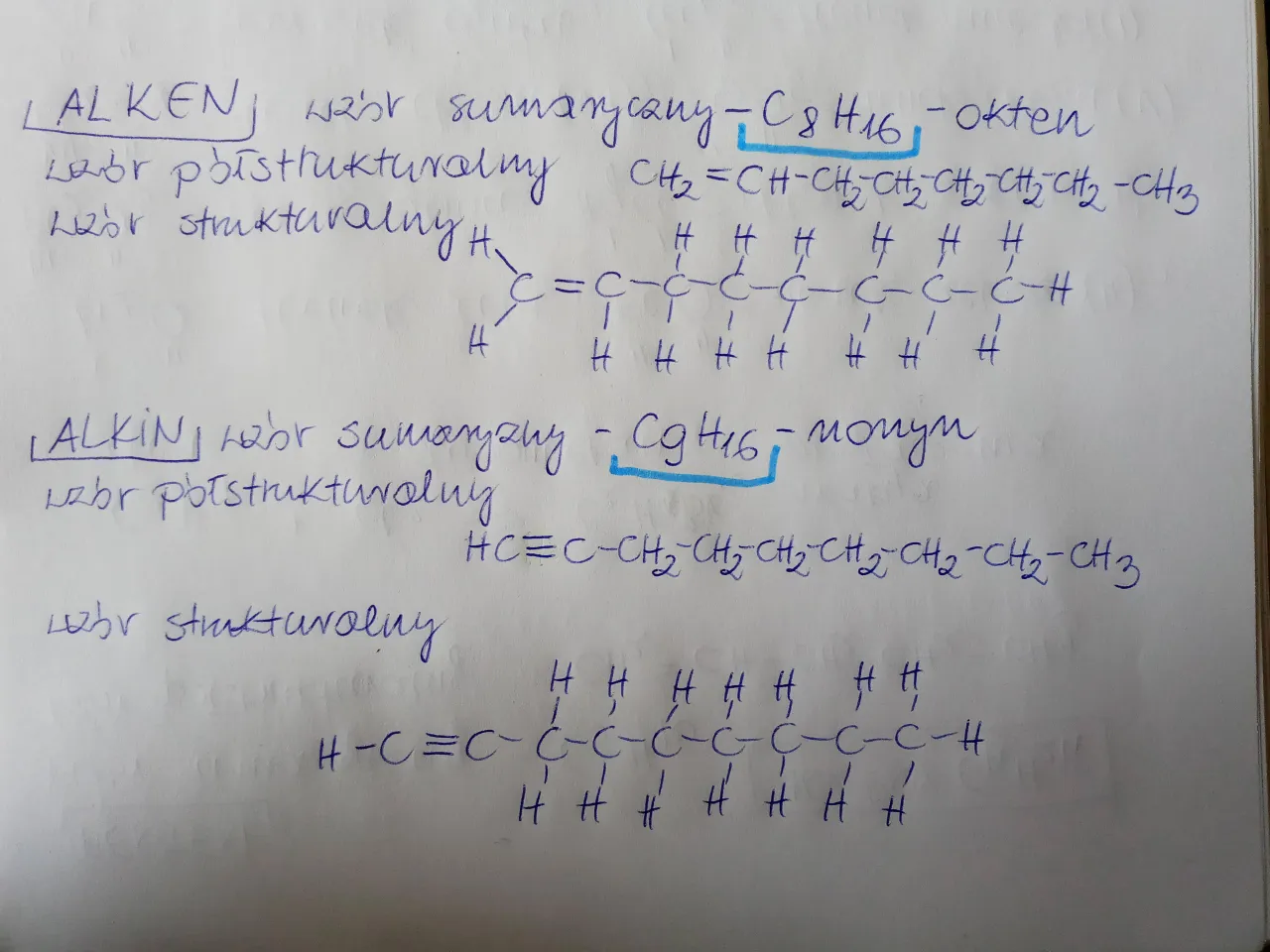
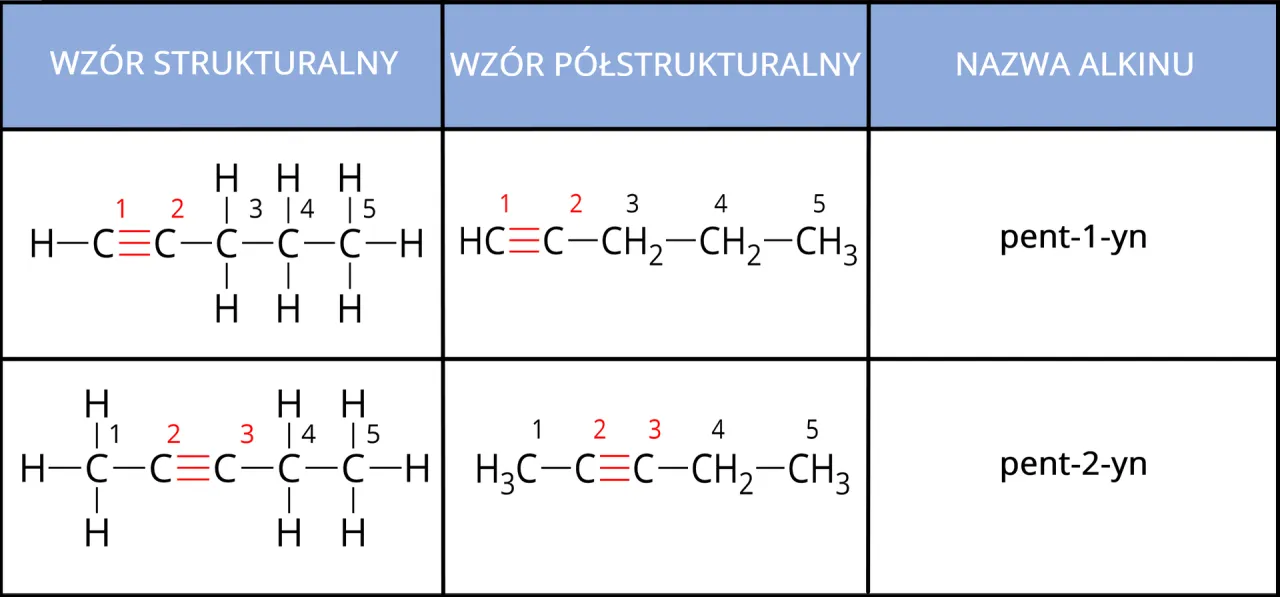
Węglowodory nienasycone: jak poradzić sobie z wiązaniami wielokrotnymi?
Wiązania podwójne i potrójne wprowadzają pewne zmiany w liczbie atomów wodoru, ale zasada wartościowości węgla pozostaje niezmienna zawsze cztery wiązania!
Rysowanie wzoru etenu (C₂H₄) i etynu (C₂H₂): zacznijmy od etenu. Ma on dwa atomy węgla i wiązanie podwójne między nimi (C=C). Ponieważ każdy węgiel tworzy już dwa wiązania z drugim węglem, potrzebuje jeszcze dwóch wiązań, aby osiągnąć wartościowość cztery. Uzupełniamy je atomami wodoru. Wzór półstrukturalny etenu to CH₂=CH₂. Dla etynu, który ma wiązanie potrójne (C≡C), każdy węgiel zużywa już trzy wiązania z drugim węglem. Potrzebuje więc tylko jednego wiązania z wodorem. Wzór półstrukturalny etynu to CH≡CH. Widzisz, jak zmienia się liczba wodorów w zależności od rodzaju wiązania?
Pamiętaj o wartościowości: jak poprawnie uzupełnić atomy wodoru? To jest kluczowe! Zawsze, gdy rysujesz wzór, sprawdź wartościowość każdego atomu węgla. Jeśli węgiel ma wiązanie podwójne, to ma już dwa wiązania "zajęte". Pozostałe dwa uzupełniasz wodorami. Jeśli ma wiązanie potrójne, ma trzy wiązania "zajęte", więc potrzebuje tylko jednego wodoru. Nigdy nie zapominaj o tej zasadzie, bo to najczęstsza przyczyna błędów.
Związki z grupami funkcyjnymi: alkohole i kwasy karboksylowe
Grupy funkcyjne to specyficzne układy atomów, które nadają cząsteczkom ich charakterystyczne właściwości. Ich prawidłowe umieszczenie we wzorze jest niezwykle ważne.
Wzór półstrukturalny etanolu (CH₃CH₂OH) na co zwrócić uwagę? Etanol to alkohol, co oznacza, że posiada grupę hydroksylową (-OH). Ważne jest, aby pamiętać, że grupa -OH zawsze łączy się z atomem węgla poprzez atom tlenu, a nie wodoru. Zapis CH₃CH₂OH wyraźnie to pokazuje: węgiel z grupy CH₂ łączy się z tlenem, a tlen z wodorem. Częstym błędem jest zapis C-H-O, co jest niepoprawne. Upewnij się, że tlen w grupie -OH ma dwa wiązania (jedno z węglem, jedno z wodorem), a wodór ma jedno wiązanie z tlenem.
Grupa karboksylowa (COOH) bez tajemnic: przykład kwasu octowego. Kwas octowy (CH₃COOH) to przykład kwasu karboksylowego, zawierającego grupę -COOH. Ta grupa jest nieco bardziej złożona: składa się z atomu węgla połączonego wiązaniem podwójnym z jednym atomem tlenu (=O) i wiązaniem pojedynczym z drugim atomem tlenu, który z kolei jest połączony z wodorem (-OH). Wzór półstrukturalny kwasu octowego to CH₃COOH. Zwróć uwagę, że grupa karboksylowa jest często zapisywana w nawiasie, jeśli jest to grupa boczna, ale w kwasach prostych jest ona na końcu łańcucha. Można ją również zapisać jako CH₃C(=O)OH, aby podkreślić wiązanie podwójne, ale CH₃COOH jest formą powszechnie akceptowaną i czytelną.
Unikaj typowych błędów przy rysowaniu wzorów
Z mojego doświadczenia wiem, że początkujący studenci chemii często popełniają te same błędy. Zwróć na nie szczególną uwagę, a zaoszczędzisz sobie wielu frustracji.
-
Najczęstszy grzech: pięciowartościowy węgiel i inne błędy wartościowości
To absolutny klasyk! Pamiętaj, że węgiel jest zawsze czterowartościowy, a wodór jednowartościowy. Nigdy, przenigdy nie rysuj pięciu wiązań do atomu węgla ani dwóch wiązań do atomu wodoru! To fundamentalne naruszenie zasad chemii. Jeśli Twój wzór wymaga pięciu wiązań przy węglu, to znaczy, że gdzieś popełniłeś błąd albo w liczbie wodorów, albo w rodzaju wiązań. Zawsze dokładnie przeliczaj wiązania wokół każdego atomu.
-
Gubienie atomów przy upraszczaniu: jak kontrolować liczbę wodorów?
Przechodząc od wzoru strukturalnego do półstrukturalnego, łatwo jest zgubić atomy wodoru lub całe grupy metylowe. Zawsze po narysowaniu wzoru półstrukturalnego policz wszystkie atomy węgla i wodoru i porównaj je z wzorem sumarycznym lub pierwotnym wzorem strukturalnym. To prosta, ale skuteczna metoda weryfikacji. Na przykład, jeśli masz propan (C₃H₈), a Twój wzór półstrukturalny to CH₃CHCH₃, to brakuje jednego wodoru!
-
Niepoprawne łączenie grup: gdzie w grupie OH znajduje się wiązanie?
W grupie hydroksylowej (-OH) wiązanie z resztą cząsteczki (z atomem węgla) jest zawsze przez atom tlenu, czyli COH. Nigdy nie rysujemy CHO. Podobnie w grupie karboksylowej (-COOH), węgiel jest połączony z tlenem grupy hydroksylowej, a nie bezpośrednio z wodorem. Zwróć uwagę na te drobne, ale krytyczne szczegóły, ponieważ wpływają one na poprawność struktury i właściwości związku.
Wzory szkieletowe: uproszczenie dla zaawansowanych
Gdy już opanujesz wzory półstrukturalne, możesz pójść o krok dalej i poznać wzory szkieletowe, zwane też kreskowymi. Są one szczególnie przydatne dla dużych i złożonych cząsteczek, gdzie nawet wzory półstrukturalne stają się mało czytelne.
Jak czytać "zygzaki"? Wprowadzenie do wzorów kreskowych. We wzorach szkieletowych pomija się symbole atomów węgla i wodoru związanych z węglem. Atomy węgla są reprezentowane przez końce i zgięcia linii. Każdy róg lub koniec linii to atom węgla. Wiązania między atomami węgla są przedstawiane jako linie. Wiązania podwójne i potrójne są odpowiednio dwoma lub trzema równoległymi liniami. Atomy wodoru związane z węglem są domyślne zakłada się, że każdy węgiel ma tyle atomów wodoru, ile potrzeba, aby osiągnąć czterowartościowość. Jedynie heteroatomy (takie jak O, N, Cl, Br) oraz atomy wodoru związane z nimi są jawnie rysowane. Na przykład, propan (CH₃CH₂CH₃) we wzorze szkieletowym wyglądałby jak prosty "zygzak" z dwoma zagięciami.
Kiedy wzór szkieletowy jest lepszy od półstrukturalnego? Wzory szkieletowe są niezastąpione dla dużych i złożonych cząsteczek, zwłaszcza tych cyklicznych lub z wieloma rozgałęzieniami. Ich główną zaletą jest czytelność i szybkość rysowania. Pozwalają one szybko zorientować się w szkielecie węglowym cząsteczki, nie gubiąc się w gąszczu symboli C i H. Na przykład, dla cykloheksanu (C₆H₁₂), zamiast pisać CH₂CH₂CH₂CH₂CH₂CH₂, rysujemy po prostu sześciokąt. To ogromne uproszczenie, które docenisz, gdy zaczniesz pracować z bardziej zaawansowanymi strukturami.
Dobre praktyki i weryfikacja poprawności wzorów
Rysowanie wzorów to umiejętność, którą doskonali się z praktyką. Oto kilka moich rad, które pomogą Ci w tym procesie.
-
Sprawdzaj dwa razy: metoda na weryfikację poprawności wzoru
Zawsze, ale to zawsze, po narysowaniu wzoru poświęć chwilę na jego weryfikację. To nawyk, który uchroni Cię przed wieloma błędami. Sprawdź wartościowość każdego atomu czy węgiel ma cztery wiązania, tlen dwa, wodór jedno? Następnie policz całkowitą liczbę atomów każdego pierwiastka i porównaj ją z wzorem sumarycznym. Jeśli coś się nie zgadza, wiesz, że musisz poszukać błędu. Ta prosta czynność jest Twoją pierwszą linią obrony przed pomyłkami.
-
Przeczytaj również: Piktogramy na środkach czystości: Twój przewodnik do bezpiecznych porządków
Czytelność przede wszystkim: dlaczego staranność rysunku ma znaczenie?
Nawet poprawny wzór, jeśli jest narysowany nieczytelnie, może prowadzić do nieporozumień. Staraj się rysować schludnie, z wyraźnymi wiązaniami i czytelnymi symbolami. Zachowaj proporcje i przestrzeń między atomami i grupami. Pamiętaj, że wzory chemiczne to język, a jak każdy język, musi być zrozumiały. Czytelny rysunek świadczy o Twoim profesjonalizmie i dbałości o szczegóły, co jest bardzo cenione w nauce.

