Zrozumienie konfiguracji elektronowej to jeden z fundamentów chemii, klucz do rozszyfrowania właściwości pierwiastków i ich zachowania w reakcjach. Jako chemik z wieloletnim doświadczeniem, mogę śmiało powiedzieć, że opanowanie tej umiejętności otwiera drzwi do głębszego pojmowania materii. W tym artykule przeprowadzę Cię krok po kroku przez wszystkie zasady i schematy, od podstawowych pojęć po najbardziej złożone przypadki i wyjątki, takie jak promocja elektronowa. Przygotuj się na kompleksowy przewodnik, który raz na zawsze rozjaśni Ci ten ważny temat.
Konfiguracja elektronowa powłokowa i podpowłokowa: schematy i zasady krok po kroku
- Konfiguracja elektronowa to opis rozmieszczenia elektronów na powłokach, podpowłokach i orbitalach atomowych.
- Kluczowe pojęcia to powłoka (K, L, M), podpowłoka (s, p, d, f) oraz orbital (obszar, w którym mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach).
- Zasady rządzące konfiguracją to: zasada najniższej energii (kolejność zapełniania orbitali, np. 4s przed 3d), zakaz Pauliego (maks. 2 elektrony na orbitalu) oraz reguła Hunda (maksymalizacja liczby niesparowanych elektronów na orbitalach zdegenerowanych).
- Istnieją cztery główne metody zapisu: powłokowy (uproszczony), pełny podpowłokowy, skrócony (z użyciem gazów szlachetnych) oraz graficzny (schemat klatkowy).
- W przypadku jonów elektrony są dodawane lub usuwane, przy czym dla kationów pierwiastków bloku d najpierw usuwa się elektrony z podpowłoki s, a dopiero potem z d.
- Należy pamiętać o wyjątkach, takich jak promocja elektronowa u chromu (Cr) i miedzi (Cu), gdzie elektron z podpowłoki s przechodzi na d dla uzyskania stabilniejszej konfiguracji (d⁵ lub d¹⁰).
Podstawy konfiguracji elektronowej: powłoki, podpowłoki i orbitale atomowe
Zanim zagłębimy się w szczegóły zapisu, musimy zrozumieć, czym w ogóle jest konfiguracja elektronowa i jakie są jej podstawowe elementy. Wyobraź sobie atom jako wielopiętrowy budynek. Każde piętro to powłoka elektronowa, oznaczana dużymi literami K, L, M, N... lub główną liczbą kwantową n (gdzie K to n=1, L to n=2 itd.). W obrębie każdego piętra (powłoki) znajdują się mniejsze "mieszkania" to podpowłoki, oznaczane literami s, p, d, f. Wreszcie, każde "mieszkanie" składa się z pojedynczych "pokoi", czyli orbitali atomowych. Orbital to nic innego jak obszar, w którym istnieje największe prawdopodobieństwo znalezienia elektronu. Co ważne, w jednym "pokoju" (orbitalu) mogą mieszkać maksymalnie dwa elektrony, ale muszą one mieć przeciwny spin, czyli różnić się jedną z liczb kwantowych.
Ile elektronów zmieści się na każdej powłoce? Wzór, który musisz znać
Każda powłoka elektronowa ma określoną maksymalną pojemność elektronową. To bardzo logiczne, bo im dalej od jądra, tym więcej "miejsca" na elektrony. Aby obliczyć maksymalną liczbę elektronów na danej powłoce, posługujemy się prostym wzorem: 2n², gdzie n to numer powłoki (lub główna liczba kwantowa). Jest to jeden z tych wzorów, które warto mieć w małym palcu.
- Dla powłoki K (n=1): 2 * 1² = 2 elektrony
- Dla powłoki L (n=2): 2 * 2² = 8 elektronów
- Dla powłoki M (n=3): 2 * 3² = 18 elektronów
Rodzaje podpowłok (s, p, d, f) i ich "pojemność" elektronowa
Wspomniałem już o podpowłokach jako "mieszkaniach" w obrębie powłok. Różnią się one nie tylko energią, ale i kształtem orbitali, co ma znaczenie w bardziej zaawansowanej chemii. Podpowłoka s ma jeden orbital o kształcie sferycznym. Podpowłoka p ma trzy orbitale o kształcie hantlowym, zorientowane wzdłuż osi X, Y i Z. Podpowłoka d ma pięć orbitali o bardziej złożonych kształtach, a podpowłoka f aż siedem. Pamiętajmy, że każdy pojedynczy orbital (czyli jeden "pokój") może pomieścić maksymalnie dwa elektrony. To kluczowa informacja, która pozwala nam ustalić pojemność każdej podpowłoki:
| Rodzaj podpowłoki | Maksymalna liczba elektronów |
|---|---|
| s (1 orbital) | 2 |
| p (3 orbitale) | 6 |
| d (5 orbitali) | 10 |
| f (7 orbitali) | 14 |
Trzy kluczowe zasady rozmieszczenia elektronów w atomie
Rozmieszczenie elektronów w atomie nie jest przypadkowe. Jest ono ściśle regulowane przez trzy fundamentalne zasady, które musimy znać i stosować, aby poprawnie zapisać konfigurację elektronową. Te zasady to nic innego jak "instrukcja obsługi" dla elektronów, mówiąca im, gdzie mają się ulokować, aby atom był jak najbardziej stabilny.Zasada #1: Kolejność zapełniania orbitali, czyli dlaczego 4s jest przed 3d?
Pierwsza i chyba najważniejsza zasada to zasada najniższej energii, znana również jako zasada Aufbau (z niemieckiego "budowanie"). Mówi ona, że elektrony w atomie zajmują orbitale o najniższej dostępnej energii. Dopiero po zapełnieniu orbitali o niższej energii, elektrony przechodzą na te o wyższej. Aby ułatwić sobie zapamiętanie tej kolejności, chemicy używają tak zwanego schematu ukośnego (zasady Madelunga). To bardzo przydatne narzędzie, które wizualnie pokazuje, że np. podpowłoka 4s jest zapełniana przed 3d, mimo że 4 jest większe niż 3. Wynika to z różnic w energii orbitali. Standardowa kolejność zapełniania podpowłok wygląda następująco:
- 1s
- 2s
- 2p
- 3s
- 3p
- 4s
- 3d
- 4p
- 5s
- 4d
- 5p
- 6s
- 4f
- 5d
- 6p
- 7s
Zasada #2: Zakaz Pauliego, czyli dlaczego w "klatce" mogą być tylko dwa elektrony?
Kolejna zasada to zakaz Pauliego. Mówi on, że w atomie nie mogą istnieć dwa elektrony o identycznym zestawie czterech liczb kwantowych. W praktyce oznacza to, że w jednym orbitalu (naszej "klatce") mogą znajdować się maksymalnie dwa elektrony. Co więcej, te dwa elektrony muszą różnić się spinem jeden będzie miał spin "w górę" (oznaczany strzałką w górę), a drugi "w dół" (strzałką w dół). To tak, jakby w jednym pokoju mogły mieszkać dwie osoby, ale musiałyby spać na przeciwnych stronach łóżka nigdy w dokładnie tej samej pozycji.
Zasada #3: Reguła Hunda dlaczego elektrony wolą być "singlami"?
Ostatnia z kluczowych zasad to reguła Hunda, która dotyczy zapełniania orbitali zdegenerowanych, czyli tych o tej samej energii (np. trzy orbitale p, pięć orbitali d). Reguła Hunda mówi, że elektrony najpierw zajmują pojedynczo każdy orbital z jednakowym spinem, a dopiero potem, jeśli są jeszcze wolne elektrony, tworzą pary na tych orbitalach. Innymi słowy, elektrony dążą do tego, by mieć jak najwięcej niesparowanych elektronów, zanim zaczną się "tłoczyć" na jednym orbitalu. To trochę jak w autobusie ludzie najpierw zajmują wolne podwójne siedzenia pojedynczo, a dopiero gdy wszystkie są zajęte, zaczynają dosiadać się do innych. Ta zasada jest kluczowa dla zrozumienia właściwości magnetycznych pierwiastków.
Praktyczny przewodnik: jak poprawnie zapisać konfigurację elektronową
Teoria to jedno, ale praktyka to drugie. Teraz, gdy znamy już podstawowe pojęcia i zasady, przejdźmy do konkretów, czyli do różnych metod zapisu konfiguracji elektronowej. Każda z nich ma swoje zastosowanie i poziom szczegółowości, a Ty musisz umieć posługiwać się każdą z nich.
Metoda 1: Zapis powłokowy szybki, ale mało dokładny
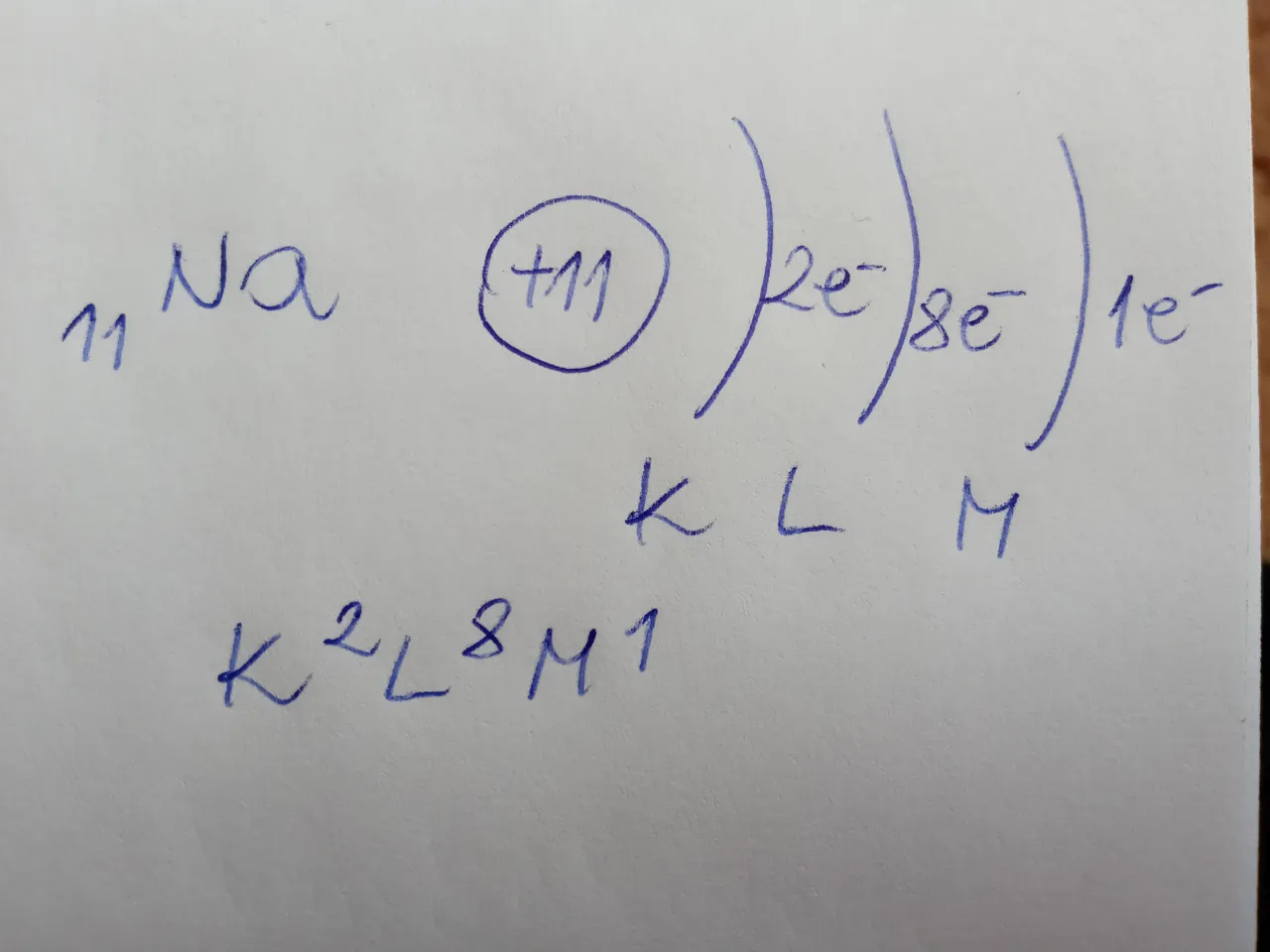
Zapis powłokowy to najbardziej uproszczona forma konfiguracji elektronowej. Pokazuje on jedynie, ile elektronów znajduje się na każdej kolejnej powłoce (K, L, M...). Jest szybki i łatwy do zapisu, ale niestety mało precyzyjny, ponieważ nie informuje nas o rozmieszczeniu elektronów w podpowłokach czy orbitalach. Moim zdaniem, jest to dobry punkt wyjścia, ale zdecydowanie niewystarczający do pełnego zrozumienia chemii.Przykład: Sód (Na, Z=11)
Atom sodu ma 11 elektronów. Zgodnie z zasadą 2n²:
- Powłoka K (n=1) mieści 2 elektrony.
- Powłoka L (n=2) mieści 8 elektronów.
- Pozostaje 1 elektron, który trafia na powłokę M.
Zapis powłokowy dla sodu to: K² L⁸ M¹
Metoda 2: Pełny zapis podpowłokowy zobacz każdy elektron na swoim miejscu
Pełny zapis podpowłokowy to znacznie bardziej szczegółowa metoda. Pokazuje ona rozmieszczenie elektronów na wszystkich podpowłokach, zgodnie z zasadą najniższej energii. To właśnie ten zapis jest najczęściej używany w chemii i pozwala na dokładne śledzenie, gdzie znajduje się każdy elektron w atomie. Wymaga on znajomości kolejności zapełniania orbitali, którą omówiliśmy wcześniej.
Przykład: Sód (Na, Z=11)
11 elektronów zapełniamy w kolejności:
- 1s² (2 elektrony)
- 2s² (2 elektrony)
- 2p⁶ (6 elektronów)
- 3s¹ (1 elektron)
Pełny zapis podpowłokowy dla sodu to: 1s² 2s² 2p⁶ 3s¹
Przykład: Tlen (O, Z=8)
8 elektronów zapełniamy w kolejności:
- 1s² (2 elektrony)
- 2s² (2 elektrony)
- 2p⁴ (4 elektrony)
Pełny zapis podpowłokowy dla tlenu to: 1s² 2s² 2p⁴
Metoda 3: Skrócony zapis podpowłokowy jak wykorzystać gazy szlachetne?
Skrócony zapis podpowłokowy to elegancki i efektywny sposób na przedstawienie konfiguracji elektronowej, szczególnie dla atomów o dużej liczbie elektronów. Wykorzystuje on fakt, że gazy szlachetne (He, Ne, Ar, Kr, Xe, Rn) mają bardzo stabilne, całkowicie zapełnione powłoki walencyjne. Zamiast pisać całą konfigurację od początku, używamy symbolu poprzedzającego gazu szlachetnego w nawiasie kwadratowym, co reprezentuje "rdzeń atomowy", a następnie dopisujemy tylko konfigurację elektronów walencyjnych. To znacznie skraca zapis i od razu wskazuje na elektrony odpowiedzialne za właściwości chemiczne.
Przykład: Sód (Na, Z=11)
Poprzedzający gaz szlachetny to Neon (Ne, Z=10), którego konfiguracja to 1s² 2s² 2p⁶.
Skrócony zapis dla sodu to: [Ne] 3s¹
Przykład: Chlor (Cl, Z=17)
Poprzedzający gaz szlachetny to Neon (Ne, Z=10).
Skrócony zapis dla chloru to: [Ne] 3s² 3p⁵
Metoda 4: Schemat klatkowy wizualny sposób na zrozumienie reguły Hunda
Schemat klatkowy (graficzny) to najbardziej wizualna metoda zapisu konfiguracji elektronowej. Orbitale są przedstawiane jako kwadraty ("klatki"), a elektrony jako strzałki (w górę dla jednego spinu, w dół dla drugiego). Ten schemat jest nieoceniony, gdy chcemy zrozumieć i zastosować zakaz Pauliego oraz regułę Hunda. Pozwala on zobaczyć, jak elektrony rozmieszczają się na orbitalach zdegenerowanych, dążąc do maksymalnej liczby niesparowanych elektronów.
Przykład: Azot (N, Z=7)
Pełna konfiguracja: 1s² 2s² 2p³
- 1s: [↑↓]
- 2s: [↑↓]
- 2p: [↑] [↑] [↑] (Trzy niesparowane elektrony, zgodnie z regułą Hunda)
Przykład: Tlen (O, Z=8)
Pełna konfiguracja: 1s² 2s² 2p⁴
- 1s: [↑↓]
- 2s: [↑↓]
- 2p: [↑↓] [↑] [↑] (Dwa niesparowane elektrony, jeden orbital p jest zapełniony parą)
Konfiguracja elektronowa dla jonów i pierwiastków bloku d
Tworzenie konfiguracji elektronowej dla jonów, a w szczególności dla pierwiastków bloku d, często sprawia uczącym się najwięcej problemów. Warto poświęcić temu zagadnieniu szczególną uwagę, bo tu łatwo o błąd.
Jak tworzyć konfigurację dla jonów dodatnich (kationów)? Kluczowa zasada dla pierwiastków z bloku d
Kationy to jony dodatnie, które powstają w wyniku utraty elektronów przez atom. Podczas tworzenia konfiguracji kationu, elektrony zawsze usuwamy z powłoki walencyjnej, czyli tej o najwyższej głównej liczbie kwantowej n. To jest dość intuicyjne elektrony najbardziej oddalone od jądra są najsłabiej związane i najłatwiej je oderwać.
Jednakże, istnieje kluczowa zasada dla pierwiastków bloku d, o której absolutnie nie wolno zapomnieć! Dla tych pierwiastków, elektrony są usuwane najpierw z podpowłoki s (np. 4s), a dopiero potem z podpowłoki d (np. 3d), nawet jeśli podpowłoka d została zapełniona wcześniej. Wynika to z faktu, że po utworzeniu jonu, energia orbitali 3d staje się niższa niż 4s, co powoduje, że elektrony 4s są usuwane jako pierwsze.
Przykład: Na⁺ (kation sodu)
- Konfiguracja atomu Na (Z=11): 1s² 2s² 2p⁶ 3s¹
- Aby utworzyć Na⁺, usuwamy 1 elektron z najbardziej zewnętrznej powłoki (3s).
- Konfiguracja Na⁺: 1s² 2s² 2p⁶ (identyczna z konfiguracją Neonu)
Przykład: Fe²⁺ (kation żelaza(II))
- Konfiguracja atomu Fe (Z=26): [Ar] 4s² 3d⁶
- Aby utworzyć Fe²⁺, usuwamy 2 elektrony. Zgodnie z zasadą dla bloku d, najpierw usuwamy elektrony z 4s.
- Konfiguracja Fe²⁺: [Ar] 3d⁶ (elektrony 4s zostały usunięte)
Jak tworzyć konfigurację dla jonów ujemnych (anionów)? Gdzie trafiają dodatkowe elektrony?
Aniony to jony ujemne, które powstają w wyniku przyjęcia elektronów przez atom. W tym przypadku dodatkowe elektrony są umieszczane na najniższym energetycznie, niecałkowicie zapełnionym orbitalu, zgodnie z zasadą najniższej energii, zakazem Pauliego i regułą Hunda. Zazwyczaj elektrony te uzupełniają podpowłoki walencyjne do stanu stabilnego, często do konfiguracji gazu szlachetnego.
Przykład: Cl⁻ (anion chlorkowy)
- Konfiguracja atomu Cl (Z=17): [Ne] 3s² 3p⁵
- Aby utworzyć Cl⁻, dodajemy 1 elektron. Trafia on na podpowłokę 3p, która ma jeszcze jedno wolne miejsce.
- Konfiguracja Cl⁻: [Ne] 3s² 3p⁶ (identyczna z konfiguracją Argonu)
Przykład: O²⁻ (anion tlenkowy)
- Konfiguracja atomu O (Z=8): 1s² 2s² 2p⁴
- Aby utworzyć O²⁻, dodajemy 2 elektrony. Trafiają one na podpowłokę 2p, która może pomieścić jeszcze 2 elektrony.
- Konfiguracja O²⁻: 1s² 2s² 2p⁶ (identyczna z konfiguracją Neonu)
Elektrony walencyjne jak je zidentyfikować i dlaczego są tak ważne?
Elektrony walencyjne to elektrony znajdujące się na najbardziej zewnętrznej powłoce atomu (lub powłokach, w przypadku pierwiastków przejściowych), które biorą udział w tworzeniu wiązań chemicznych. To właśnie one decydują o właściwościach chemicznych pierwiastka, jego reaktywności, typie wiązań, jakie tworzy, czy liczbie utlenienia. Ich identyfikacja jest kluczowa dla zrozumienia chemii.
- Dla pierwiastków bloku s i p (grupy główne): Elektrony walencyjne to wszystkie elektrony na powłoce o najwyższej głównej liczbie kwantowej n.
- Dla pierwiastków bloku d (metale przejściowe): Elektrony walencyjne to elektrony z ostatniej podpowłoki s oraz z przedostatniej (n-1) podpowłoki d.
Przykłady identyfikacji elektronów walencyjnych:
- Sód (Na, Z=11): 1s² 2s² 2p⁶ 3s¹. Elektrony walencyjne: 3s¹ (1 elektron).
- Chlor (Cl, Z=17): [Ne] 3s² 3p⁵. Elektrony walencyjne: 3s² 3p⁵ (7 elektronów).
- Żelazo (Fe, Z=26): [Ar] 4s² 3d⁶. Elektrony walencyjne: 4s² 3d⁶ (8 elektronów).
Wyjątki od reguł: zjawisko promocji elektronowej
Chemia, jak wiele dziedzin nauki, ma swoje reguły, ale także i wyjątki. Jednym z najważniejszych i najczęściej pojawiających się w zadaniach jest zjawisko promocji elektronowej. Jeśli zrozumiesz ten mechanizm, będziesz o krok przed wieloma, którzy uczą się chemii.
Na czym polega zjawisko promocji elektronowej?
Promocja elektronowa to zjawisko, w którym jeden elektron z podpowłoki s (np. 4s) "przeskakuje" na podpowłokę d (np. 3d), która znajduje się na niższej głównej liczbie kwantowej, ale ma zbliżoną energię. Dzieje się tak, ponieważ atom dąży do uzyskania jak najbardziej stabilnej konfiguracji elektronowej. Konfiguracje, w których podpowłoka d jest w połowie zapełniona (d⁵) lub całkowicie zapełniona (d¹⁰), są energetycznie korzystniejsze i bardziej stabilne niż inne układy. To trochę jak dążenie do symetrii i porządku natura to lubi, a atomy również.
Przypadek chromu (Cr) i miedzi (Cu) dlaczego ich konfiguracje są inne niż oczekiwane?
Chrom i miedź to sztandarowe przykłady pierwiastków, które wykazują promocję elektronową. Warto je zapamiętać, bo są to najczęściej testowane wyjątki.
Chrom (Cr, Z=24)
- Oczekiwana konfiguracja (zgodnie z zasadą Aufbau): [Ar] 4s² 3d⁴
- Gdyby chrom zachował tę konfigurację, miałby podpowłokę 3d z czterema elektronami.
- Rzeczywista konfiguracja (po promocji elektronowej): [Ar] 4s¹ 3d⁵
- Jeden elektron z podpowłoki 4s przeskakuje na 3d, tworząc układ 3d⁵, który jest połowicznie zapełniony i dzięki temu znacznie bardziej stabilny.
Miedź (Cu, Z=29)
- Oczekiwana konfiguracja (zgodnie z zasadą Aufbau): [Ar] 4s² 3d⁹
- Gdyby miedź zachowała tę konfigurację, miałaby podpowłokę 3d z dziewięcioma elektronami.
- Rzeczywista konfiguracja (po promocji elektronowej): [Ar] 4s¹ 3d¹⁰
- Jeden elektron z podpowłoki 4s przeskakuje na 3d, tworząc układ 3d¹⁰, który jest całkowicie zapełniony i dzięki temu również znacznie bardziej stabilny.
Czy istnieją inne przykłady promocji? Krótki przegląd
Chrom i miedź to najbardziej znane przykłady promocji elektronowej, ale nie jedyne. Zjawisko to występuje również u innych pierwiastków, takich jak srebro (Ag), złoto (Au) czy molibden (Mo). Mechanizm jest zawsze ten sam dążenie do uzyskania stabilnej, połowicznie lub całkowicie zapełnionej podpowłoki d (lub f), kosztem podpowłoki s. Jednak dla większości celów edukacyjnych, skupienie się na chromie i miedzi jest w zupełności wystarczające.
Jak bezbłędnie zapisać każdą konfigurację? Podsumowanie i wskazówki
Zapisywanie konfiguracji elektronowej to umiejętność, którą można doskonalić. Mam nadzieję, że ten przewodnik rozwiał wiele Twoich wątpliwości. Aby utrwalić wiedzę i zapewnić sobie bezbłędne wyniki, przygotowałem dla Ciebie checklistę i listę najczęstszych błędów, których należy unikać.
Checklista: 4 kroki do poprawnego zapisu konfiguracji elektronowej
- Określ liczbę elektronów: Zawsze zaczynaj od sprawdzenia liczby atomowej (Z) pierwiastka, która mówi Ci, ile protonów, a w neutralnym atomie, ile elektronów ma dany pierwiastek. Jeśli to jon, odpowiednio dodaj lub odejmij elektrony.
- Zastosuj zasadę Aufbau (kolejność zapełniania): Użyj schematu ukośnego, aby poprawnie zapełnić podpowłoki w kolejności wzrastającej energii (1s, 2s, 2p, 3s, 3p, 4s, 3d...).
- Zastosuj zakaz Pauliego i regułę Hunda: Pamiętaj, że na jednym orbitalu mogą być maksymalnie dwa elektrony o przeciwnych spinach (zakaz Pauliego). Przy zapełnianiu orbitali zdegenerowanych (p, d, f) najpierw umieść po jednym elektronie z tym samym spinem, a dopiero potem sparuj pozostałe (reguła Hunda).
- Sprawdź wyjątki i przypadki specjalne: Zawsze pamiętaj o promocji elektronowej (Cr, Cu) oraz o specjalnych zasadach dla jonów, zwłaszcza dla kationów pierwiastków bloku d (najpierw usuwamy elektrony z s, potem z d).
Przeczytaj również: Hodowla kryształów soli: Prosta instrukcja krok po kroku w domu
Najczęstsze błędy i jak ich unikać praktyczne wskazówki
- Błędna kolejność zapełniania (np. 3d przed 4s): To chyba najczęstszy błąd. Zawsze miej pod ręką schemat ukośny lub po prostu zapamiętaj, że 4s jest zawsze zapełniane przed 3d!
- Ignorowanie reguły Hunda: Często studenci od razu parują elektrony na orbitalach zdegenerowanych. Pamiętaj, najpierw po jednym elektronie z tym samym spinem, potem parowanie. Narysuj schemat klatkowy, to bardzo pomaga!
- Błędy przy jonach d-blokowych: Zapominanie, że dla kationów pierwiastków przejściowych elektrony są usuwane najpierw z podpowłoki s, a dopiero potem z d. To krytyczna zasada, którą musisz opanować.
- Zapominanie o promocji elektronowej: Chrom i miedź to Twoi "przyjaciele" zawsze sprawdzaj, czy nie masz do czynienia z tymi pierwiastkami. Ich konfiguracje są wyjątkowe i często pojawiają się na egzaminach.
- Niewłaściwa liczba elektronów: Zawsze dokładnie policz elektrony, zwłaszcza przy jonach. Łatwo jest pomylić się o jeden elektron, co całkowicie zmienia konfigurację.

