Prawidłowe krzepnięcie krwi to złożony mechanizm obronny organizmu z kluczową rolą płytek.
- Krzepnięcie krwi (hemostaza) to dwuetapowy proces: hemostaza pierwotna (rola naczyń i płytek) i hemostaza wtórna (kaskada czynników krzepnięcia).
- Płytki krwi (trombocyty) inicjują hemostazę pierwotną poprzez adhezję, aktywację i agregację, tworząc tymczasowy czop płytkowy.
- Hemostaza wtórna polega na kaskadowej aktywacji czynników krzepnięcia, co prowadzi do przekształcenia fibrynogenu w stabilną fibrynę i powstania trwałego skrzepu.
- Witamina K, jony wapnia oraz zdrowa wątroba są niezbędne do prawidłowej syntezy i funkcjonowania wielu czynników krzepnięcia.
- Fibrynoliza to naturalny mechanizm rozpuszczania skrzepu po zagojeniu rany, mający na celu przywrócenie drożności naczyń.
- Zaburzenia krzepnięcia obejmują skazy krwotoczne (niedostateczne krzepnięcie) i trombofilię (nadmierną skłonność do zakrzepów).
Prawidłowe krzepnięcie krwi cichy strażnik Twojego życia
Zapewne nie zastanawiasz się nad tym na co dzień, ale prawidłowe krzepnięcie krwi to jeden z najbardziej fundamentalnych mechanizmów, który chroni Twoje życie. Każde, nawet najmniejsze skaleczenie, uruchamia skomplikowaną serię reakcji, która ma tylko jeden cel: szybko zatamować krwawienie i zapobiec utracie cennego płynu. Bez tego inteligentnego systemu, nawet drobne urazy mogłyby stanowić poważne zagrożenie.
Hemostaza: inteligentny system obronny organizmu w pigułce
Hemostaza to nic innego jak ogół procesów fizjologicznych, które mają na celu utrzymanie krwi w stanie płynnym w naczyniach krwionośnych, a jednocześnie szybkie zatamowanie krwawienia w przypadku ich uszkodzenia. To złożony mechanizm obronny organizmu, który działa w dwóch głównych etapach: hemostazie pierwotnej i hemostazie wtórnej. Co ważne, równolegle do procesów krzepnięcia, działa również fibrynoliza, czyli mechanizm odpowiedzialny za rozpuszczanie skrzepu, gdy ten przestanie być potrzebny.
Kiedy krzepnięcie zawodzi: od siniaków po stany zagrażające życiu
Choć hemostaza jest zazwyczaj niezwykle efektywna, czasami jej delikatna równowaga zostaje zachwiana. Zaburzenia krzepnięcia mogą mieć bardzo poważne konsekwencje. Z jednej strony, niedostateczne krzepnięcie objawia się nadmiernymi krwawieniami, łatwym powstawaniem siniaków czy trudnościami w gojeniu ran. Z drugiej strony, nadmierne krzepnięcie, czyli tak zwana nadkrzepliwość, może prowadzić do tworzenia się niebezpiecznych zakrzepów, które z kolei mogą zablokować naczynia krwionośne, wywołując zakrzepicę, zatorowość płucną, a nawet zawał serca czy udar mózgu. Zrozumienie tych mechanizmów jest kluczowe dla oceny ryzyka i profilaktyki wielu chorób.
Płytki krwi pierwsza linia obrony i początek akcji ratunkowej
Trombocyty pod mikroskopem: kim są główni bohaterowie hemostazy?
Gdy dochodzi do uszkodzenia naczynia krwionośnego, do akcji natychmiast wkraczają płytki krwi, zwane również trombocytami. To fascynujące, małe, bezjądrzaste fragmenty komórek, które powstają w szpiku kostnym z olbrzymich komórek megakariocytów. Ich główna rola polega na inicjowaniu hemostazy pierwotnej, czyli pierwszej, szybkiej reakcji na uraz. Płytki to prawdziwi specjaliści od "szybkiego reagowania", gotowi do działania w ułamku sekundy.
Krok 1: Adhezja, czyli błyskawiczne przyleganie do miejsca urazu
Pierwszym etapem działania płytek krwi jest adhezja, czyli ich przyleganie do uszkodzonej ściany naczynia. W normalnych warunkach, gdy naczynie jest zdrowe, płytki nie przylegają do jego gładkiej, wewnętrznej powierzchni. Jednak w momencie urazu, pod warstwą komórek śródbłonka odsłonięte zostają włókna kolagenu. To właśnie do nich, niczym do magnesu, błyskawicznie przylegają płytki krwi, rozpoczynając proces tamowania krwawienia.
Krok 2: Aktywacja i agregacja jak płytki wzywają posiłki i tworzą czop?
Po adhezji płytki ulegają aktywacji. Zmieniają swój kształt, stają się bardziej kolczaste i uwalniają z ziarnistości szereg substancji chemicznych. Do najważniejszych z nich należą ADP (adenozynodifosforan), serotonina i tromboksan A2. Te substancje działają jak sygnały alarmowe, przyciągając kolejne płytki krwi do miejsca urazu. Następnie dochodzi do agregacji, czyli zlepiania się płytek ze sobą, co prowadzi do utworzenia pierwotnego, niestabilnego czopu płytkowego. Jest to tymczasowa "łatka", która natychmiastowo, choć jeszcze nie trwale, tamuje krwawienie.
Rola czynnika von Willebranda: kluczowy pośrednik w działaniu płytek
W procesie adhezji i aktywacji płytek krwi niezwykle istotną rolę odgrywa czynnik von Willebranda (vWF). To duże białko, które działa jak most, łącząc płytki krwi z odsłoniętym kolagenem w uszkodzonej ścianie naczynia. Bez niego adhezja płytek byłaby znacznie mniej efektywna, co prowadziłoby do poważnych zaburzeń krzepnięcia, takich jak choroba von Willebranda.
Kaskada krzepnięcia skomplikowany proces tworzenia stabilnego skrzepu
Hemostaza wtórna: czym różni się od działania płytek krwi?
Po utworzeniu pierwotnego czopu płytkowego, do akcji wkracza hemostaza wtórna. O ile płytki krwi działają natychmiastowo, tworząc tymczasową zaporę, o tyle hemostaza wtórna ma za zadanie wzmocnić i ustabilizować ten czop, przekształcając go w trwały skrzep. Polega to na aktywacji serii białek osocza, zwanych czynnikami krzepnięcia, które działają w skomplikowanej kaskadzie.
Szlak zewnątrzpochodny vs. wewnątrzpochodny: dwie drogi do jednego celu
Kaskada krzepnięcia może być aktywowana dwoma głównymi szlakami: wewnątrzpochodnym i zewnątrzpochodnym. Oba te szlaki, choć inicjowane w różny sposób, ostatecznie prowadzą do wspólnej drogi krzepnięcia, której celem jest wytworzenie fibryny.
Szlak wewnątrzpochodny jest uruchamiany, gdy krew ma kontakt z uszkodzoną powierzchnią naczynia, a konkretnie z odsłoniętym kolagenem. Jest to proces nieco wolniejszy, ale niezwykle ważny w przypadku rozległych uszkodzeń wewnętrznych.
Z kolei szlak zewnątrzpochodny jest inicjowany przez czynnik tkankowy (tromboplastynę), który jest uwalniany z uszkodzonych komórek otaczających naczynie. Ten szlak jest szybszy i odgrywa kluczową rolę w początkowej fazie krzepnięcia po urazie zewnętrznym.
Rola trombiny: dyrygent orkiestry krzepnięcia
Niezależnie od tego, który szlak zostanie aktywowany, oba prowadzą do powstania kluczowego enzymu trombiny. Trombina powstaje z nieaktywnej formy, protrombiny (czynnika II), i można ją porównać do dyrygenta orkiestry krzepnięcia. To właśnie ona inicjuje dalsze, decydujące etapy procesu, przekształcając fibrynogen w fibrynę i aktywując inne czynniki krzepnięcia, co prowadzi do ostatecznej stabilizacji skrzepu.
Od fibrynogenu do fibryny: jak powstaje rusztowanie skrzepu?
Kluczowym zadaniem trombiny jest przekształcenie rozpuszczalnego w osoczu białka fibrynogenu (czynnik I) w nierozpuszczalną fibrynę. To właśnie włókna fibryny tworzą gęstą, trójwymiarową sieć, która oplata i stabilizuje pierwotny czop płytkowy. Ta sieć działa jak rusztowanie, w które wplątują się krwinki czerwone i inne elementy krwi, tworząc ostateczny, trwały i wytrzymały skrzep. Dzięki temu krwawienie zostaje skutecznie zatrzymane, a rana może rozpocząć proces gojenia.
Niezbędni pomocnicy w procesie krzepnięcia
Witamina K: dlaczego jej niedobór jest tak niebezpieczny?
W procesie krzepnięcia krwi nie tylko płytki i czynniki osoczowe odgrywają kluczową rolę. Niezbędne są również pewne substancje pomocnicze. Jedną z nich jest witamina K. Jest ona absolutnie kluczowa dla prawidłowej syntezy w wątrobie kilku bardzo ważnych czynników krzepnięcia, a mianowicie czynników II (protrombiny), VII, IX i X. Bez odpowiedniej ilości witaminy K, czynniki te nie mogą być w pełni aktywne, co prowadzi do poważnych zaburzeń krzepnięcia i skłonności do krwawień. To dlatego jej niedobór jest tak niebezpieczny.
Jony wapnia: mały pierwiastek, wielka rola w kaskadzie
Innym, często niedocenianym, ale niezwykle ważnym elementem są jony wapnia (Ca2+). Ten mały pierwiastek odgrywa wielką rolę, będąc koniecznym kofaktorem na wielu etapach kaskady krzepnięcia. Bez odpowiedniego stężenia jonów wapnia, wiele reakcji enzymatycznych w procesie krzepnięcia nie mogłoby zajść prawidłowo.
Zdrowa wątroba a krzepnięcie: gdzie powstają kluczowe czynniki?
Nie możemy zapomnieć o wątrobie to właśnie ten organ jest głównym "producentem" większości osoczowych czynników krzepnięcia. Jej prawidłowe funkcjonowanie jest absolutnie niezbędne dla utrzymania hemostazy. Choroby wątroby, takie jak marskość czy niewydolność, mogą prowadzić do znacznego upośledzenia syntezy tych białek, co skutkuje poważnymi zaburzeniami krzepnięcia i zwiększonym ryzykiem krwawień.
Porządek musi być na czym polega proces rozpuszczania skrzepu?
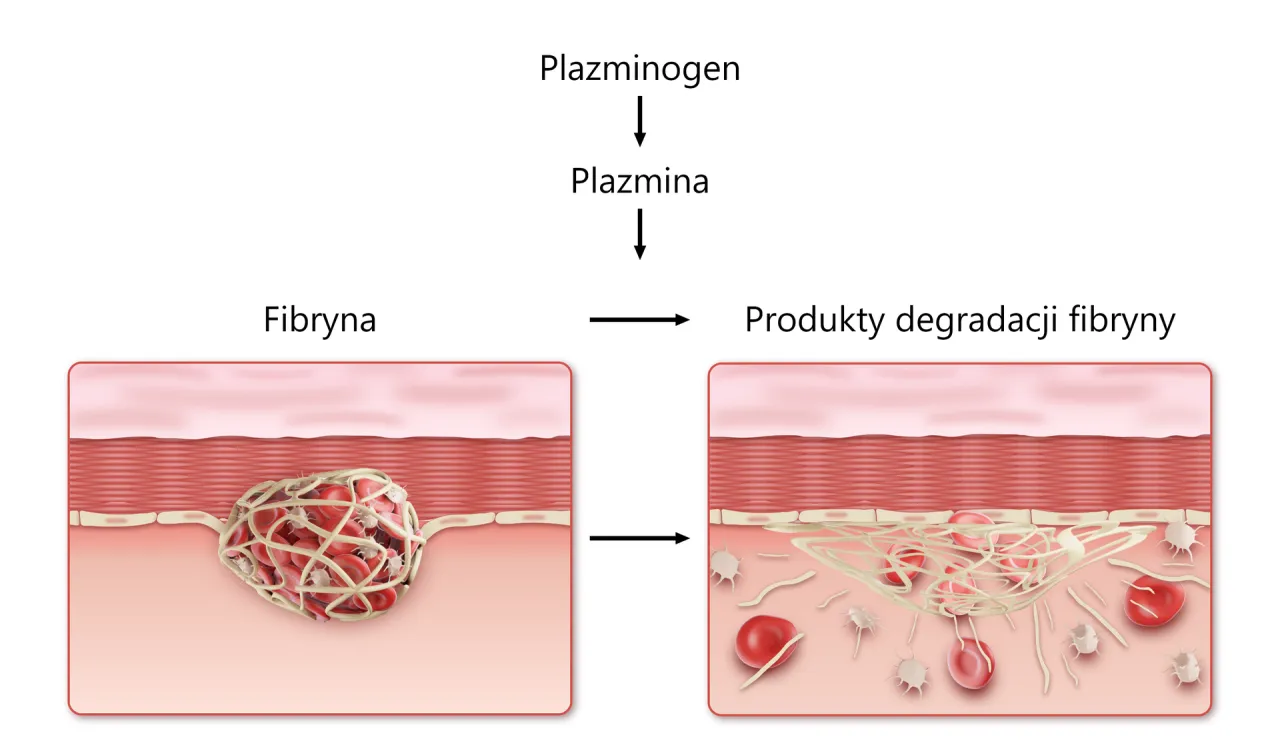
Fibrynoliza: naturalny mechanizm przywracania drożności naczyń
Gdy rana się zagoi, a uszkodzone naczynie zostanie naprawione, skrzep przestaje być potrzebny. W tym momencie do akcji wkracza kolejny, równie ważny mechanizm fibrynoliza. Jest to naturalny proces usuwania skrzepu, mający na celu przywrócenie prawidłowego przepływu krwi w naczyniu. Bez fibrynolizy, skrzepy mogłyby patologicznie narastać, prowadząc do zablokowania naczyń i poważnych konsekwencji zdrowotnych.
Plazmina: enzym, który tnie fibrynową sieć
Kluczowym enzymem odpowiedzialnym za fibrynolizę jest plazmina. Powstaje ona z nieaktywnego prekursora, plazminogenu, pod wpływem specyficznych aktywatorów (np. tkankowego aktywatora plazminogenu, t-PA). Plazmina działa jak precyzyjne nożyczki, tnąc włókna fibryny, które tworzą rusztowanie skrzepu. W efekcie skrzep ulega rozpuszczeniu, a drożność naczynia zostaje przywrócona.
Równowaga między krzepnięciem a fibrynolizą: dlaczego jest kluczowa?
Jak widać, w naszym organizmie panuje niezwykła równowaga. Z jednej strony mamy procesy krzepnięcia, które szybko tamują krwawienie, z drugiej fibrynolizę, która usuwa skrzep, gdy ten przestaje być potrzebny. Zachowanie tej delikatnej równowagi jest absolutnie kluczowe dla prawidłowego funkcjonowania układu krwionośnego. Jej zaburzenie może prowadzić zarówno do nadmiernych krwawień, jak i do niebezpiecznego tworzenia się zakrzepów, co podkreśla złożoność i precyzję tego biologicznego systemu.
Gdy mechanizm zawodzi najczęstsze zaburzenia krzepnięcia krwi
Skazy krwotoczne: kiedy krew krzepnie zbyt wolno (hemofilia, małopłytkowość)
Niestety, mechanizm krzepnięcia krwi nie zawsze działa perfekcyjnie. Jedną z grup zaburzeń są skazy krwotoczne, charakteryzujące się niedostatecznym krzepnięciem krwi. Mogą być one spowodowane różnymi czynnikami, takimi jak niedobór płytek krwi (małopłytkowość), niedobór konkretnych czynników krzepnięcia (np. hemofilia A lub B, choroba von Willebranda), czy też niedobór witaminy K. Objawy skaz krwotocznych to zazwyczaj nadmierne krwawienia (np. z nosa, dziąseł), łatwe powstawanie siniaków, przedłużające się krwawienia po drobnych urazach czy zabiegach.
Trombofilia (nadkrzepliwość): ciche zagrożenie zakrzepicą i zatorem
Po drugiej stronie spektrum znajdują się zaburzenia znane jako trombofilia, czyli zwiększona skłonność do tworzenia zakrzepów w naczyniach krwionośnych. Jest to ciche zagrożenie, które często nie daje wyraźnych objawów, dopóki nie dojdzie do poważnego incydentu. Trombofilia może być wrodzona lub nabyta i znacząco zwiększa ryzyko rozwoju zakrzepicy żył głębokich, zatorowości płucnej, a także powikłań takich jak zawał serca czy udar mózgu. Wczesna diagnostyka jest w tych przypadkach kluczowa.
Jak sprawdzić, czy Twój układ krzepnięcia działa prawidłowo?
Koagulogram: podstawowe badanie, które powinieneś znać
Jeśli masz podejrzenia, że Twój układ krzepnięcia nie działa prawidłowo, lub po prostu chcesz sprawdzić jego kondycję, podstawowym badaniem diagnostycznym jest koagulogram. To zestaw testów laboratoryjnych, który pozwala ocenić różne parametry procesu krzepnięcia krwi, dając kompleksowy obraz jego funkcjonowania. Koagulogram jest często wykonywany przed operacjami, w przypadku krwawień, siniaków, a także u pacjentów przyjmujących leki przeciwzakrzepowe.
Co oznaczają wskaźniki PT, INR i APTT w wynikach badań?
Wśród najważniejszych składowych koagulogramu znajdziesz kilka kluczowych wskaźników:
- Czas protrombinowy (PT) z INR: Ocenia sprawność szlaku zewnątrzpochodnego i wspólnej drogi krzepnięcia. Wskaźnik INR (International Normalized Ratio) jest szczególnie ważny u pacjentów przyjmujących doustne antykoagulanty, takie jak warfaryna, ponieważ pozwala na standaryzację wyników niezależnie od laboratorium.
- Czas kaolinowo-kefalinowy (APTT): Pozwala ocenić szlak wewnątrzpochodny i wspólną drogę krzepnięcia. Jest używany do monitorowania leczenia heparyną niefrakcjonowaną.
- Stężenie fibrynogenu: Informuje o ilości fibrynogenu, czyli prekursora fibryny, kluczowego białka tworzącego skrzep. Jego niedobór lub nadmiar może świadczyć o zaburzeniach krzepnięcia.
- Liczba płytek krwi: Choć często badana w ramach morfologii krwi, jest niezwykle istotnym elementem oceny hemostazy, ponieważ ich niedobór (małopłytkowość) lub nadmiar (nadpłytkowość) bezpośrednio wpływa na zdolność krwi do krzepnięcia.
Przeczytaj również: Funkcje mitochondriów: Energia, choroby i sekrety długiego życia

